[山东]2012-2013学年山东省聊城市高一上学期七校联考期末检测化学试卷
已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是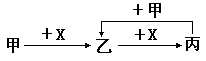
| A.甲为C,X是O2 | B.甲为SO2,X是NaOH溶液 |
| C.甲为Cl2,X为Fe | D.甲为Al,X为NaOH溶液 |
下列物质中,能给水杀菌消毒的是
| A.明矾 | B.Fe2(SO4)3 | C.漂粉精 | D.纯碱 |
在下列固体中分别加入NaOH浓溶液,固体溶解但无气体生成的是
| A.SiO2 | B.Na | C.Al | D.NH4Cl |
在下列物质间的反应中,酸既表现出氧化性又表现出酸性的是
| A.浓盐酸和高锰酸钾 | B.浓硝酸和铜屑 | C.稀硝酸和SO2 | D.浓硫酸和碳 |
将23g Na和24g Mg分别投入等质量的过量的盐酸中,反应完毕后,所得溶液的质量分数分别为m和n,则m和n的关系是
| A.m>n | B.m=n | C.m<n | D.无法确定 |
下列叙述中,不符合化学史事实的是( )
| A.法国化学家拉瓦锡建立燃烧现象的氧化学说使近代化学取得了革命性进展 |
| B.英国化学家在世界上首次合成了具有生物活性的蛋白质-------牛胰岛素 |
| C.以碳及其化合物为原料制成的芯片和光导纤维引领我们进入了信息时代 |
| D.经过化学家们的不断努力,从自然界中发现以及人工制造出的化合物已经超过3500万种 |
设NA为阿佛加德罗常数,下列说法正确的是( )
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③1L 2mol/L的MgCl2溶液中含氯离子为4NA
④标准状况下22.4LH2O中分子数为NA
⑤32g O2和O3混合气体中含有原子数为2NA
| A.①②③④ | B.③④ | C.①③④ | D.①②③⑤ |
能正确表示下列化学反应的离子方程式的是( )
| A.氢氧化钡溶液与硫酸的反应 OH-+H+= H2O |
| B.澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+= Ca2+ + 2H2O |
| C.铜片插入硝酸银溶液中 Cu + Ag+= Cu2+ + Ag |
| D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2 |
下列说法正确的是
| A.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的 |
| B.可以采用蒸发浓缩、冷却结晶的方法从硝酸钾溶液中获得硝酸钾晶体 |
| C.将乙醇与水分离,如图1、图2操作 |
| D.稀释浓H2SO4,如图3操作 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,0.1molCl2溶于水,Cl2与水发生反应转移的电子数目为0.1NA |
| B.常温常压下,0.2molAl与足量NaOH溶液反应,转移电子数为0.6 NA |
| C.常温常压下,500 mL 0.1mol/L醋酸溶液中含有分子的总数目为0.05NA |
| D.常温常压下,16g CH4与18 g NH4+所含质子数相等 |
下列叙述中,正确的是
A.含金属元素的离子一定都是阳离子
B.现代化学分析测试中,常借助一些仪器来分析化学物质组成。例如,可用元素分析仪确定C、H、O等元素,用红外光谱仪确定物质中的有机原子团,用原子吸收光谱确定物质中含有哪些非金属元素
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是
下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的一组是
| |
物质 |
杂质 |
除杂试剂或操作方法 |
| ① |
酒精 |
水 |
蒸馏 |
| ② |
H2 |
CO2 |
通过盛有NaOH溶液洗气瓶,再通过盛有浓硫酸洗气瓶 |
| ③ |
NaNO3 |
CaCO3 |
溶解、过滤、蒸发 |
| ④ |
NaCl |
I2 |
加热 |
| ⑤ |
KNO3溶液 |
AgNO3 |
加入NaCl溶液,过滤 |
A.①④⑤ B.③④⑤ C.①②③④ D.①②③⑤
某氯原子的质量为a g , C-12原子的质量为b g,用NA表示阿伏加德罗常数,下列说法中不正确的是
A.则该氯原子构成氯分子的相对分子质量为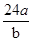 |
| B.1mol该氯原子的质量为aNAg |
C.mg该氯原子的物质的量为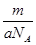 mol mol |
D.ng该氯原子所含的电子数为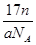 |
下列示意图与对应的反应情况正确的是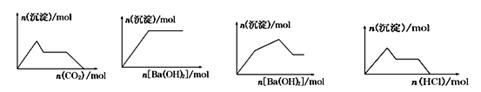
A B C D
| A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2 |
| B.NaHSO4溶液中逐滴加入Ba(OH)2溶液 |
| C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 |
| D.NaAlO2溶液中逐滴加入盐酸 |
FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。请写出反应的离子方程式 。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂。实验室制取氢氧化铁胶体的方法是 (填字母序号)。
| A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可。 |
| B.在FeCl3溶液中加入足量的NaOH溶液 |
| C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体 |
| D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀 |
证明此胶体已经制成的最简单方法为 。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:2FeCl3+ 2KI = 2FeCl2+ I2+2KI,在上式上用双线桥法标出该反应电子转移的方向和数目。向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为 色,再将混合液倒入 (填仪器名称)中,将两层液体分离。
已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色。J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。
请填写下列空白
(1)写出化学式:D ,K 。
(2)写出②的离子方程式 。
(3)反应④不属于下列何种反应类型 (填字母序号)。
A.化合反应 B.氧化还原反应 C.离子反应 D.置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为 (填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN
C.浓氨水 D.酸性高锰酸钾溶液
(5)将F加入到M的溶液里并露置在空气中,可以观察到整个过程的现象是:
。
(6)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式 。
现有失去标签的CaCl2、AgNO3、HCl、和Na2CO3四瓶溶液。为了确定四种溶液的成分,将它们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 |
实验内容 |
实验现象 |
| ① |
A + B |
无明显现象 |
| ② |
B + D |
有无色无味气体放出 |
| ③ |
C + B |
有白色沉淀生成 |
| ④ |
A + D |
有白色沉淀生成 |
根据上述实验完成下列各小题:
(1)A、B、C、D四瓶溶液分别是(用化学式表示所含溶质)
A B C D
(2)写出B与D反应的离子方程式
写出B与C反应的离子方程式
用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③酒精灯;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取Na2CO3的质量为 g;若称量时砝码和物品放反了,则实际称量的Na2CO3的质量为 g 。
(3)下列操作,会引起所配溶液浓度偏高的是( )
| A.称取的Na2CO3固体中有杂质 |
| B.溶解Na2CO3固体时,因搅拌剧烈使烧杯中的溶液溅出少量 |
| C.没有洗涤烧杯及玻璃棒 |
| D.定容时发现液面高于刻度线,用胶头滴管吸出多余的溶剂 |
E、定容时仰视刻度线
F、定容时俯视刻度线
G、定容摇匀后,发现液面低于刻度线,再加至刻度线
(4)取所配Na2CO3溶液20ml,向其中滴加足量的稀盐酸,可得到标况下的气体 L,将得到的气体全部通入足量的澄清石灰水,充分反应后,将沉淀过滤,洗涤,干燥,最后可得固体 g。
下图是一位学生设计的实验室制取和收集氯气并验证其性质的装置图。
(1)找出在此装置图中出现的错误加以改正。
(2)实验过程中,在D装置中观察到的实验现象是 ;在E装置中观察到的实验现象是 ,反应的化学方程式是 ;
(3)F装置的作用是 ,反应的离子方程式是 。
(一)(4分)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)实验室配制480ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。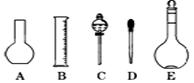
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了 种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
| A.配制前没有将容量瓶中的水除尽; |
| B.碳酸钠失去了部分结晶水; |
| C.碳酸钠晶体不纯,其中混有氯化钠; |
| D.称量碳酸钠晶体时所用砝码生锈; |
E.定容时仰视刻度线
某化学学习小组欲探究铁及其化合物的氧化性和还原性。请你协助他们完成实验报告。
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是 。
| 序号 |
实验设计 |
实验观察(主要现象) |
离子方程式 |
解释与结论 |
| ① |
在铁粉中滴 入稀硫酸 |
铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的的气体生成 |
Fe +2H+= H2↑+ Fe2+ |
Fe具有还原性 |
| ② |
氯化亚铁溶液中滴入KSCN溶液,再加入氯水 |
滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 |
|
|
| ③ |
氯化亚铁溶液加 入锌片 |
|
Fe2++ Zn =" Fe" + Zn 2++ |
|
| ④ |
|
|
|
Fe3+具有氧化性 |
(3)实验记录(在仿照①实验作答,划线部分不必填写)
(4)学习小组的同学将从本实验中获得的知识推广到其他类物质的学习,请判断下列物质既有氧化性又有还原性的是
A、Cl2 B、Na C、Mg2+ D、H2O2
(5)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,你认为是什么原因: ;
你将对实验员在配制氯化亚铁溶液时,提出的建议是 。
(6)在配制氯化铁溶液时,由于实验员失误,可能导致溶液中含有少量的Fe2+,为帮助实验员进行检验少量Fe2+的存在,请从下列物质中选择合适的试剂( )
A、KSCN溶液 B、稀盐酸 C、KMnO4溶液 D、NaOH溶液
某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取“化学纯”级的NaCl,实验前他们设计了如下方案(框图)。 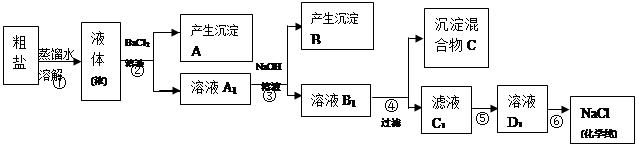
(1)请写出操作第④、⑤步所加试剂名称及第⑥步操作名称:④ ,⑤ ,⑥ ;
(2) 沉淀混合物C的化学成分有(用文字和化学式表示): ;
(3)写出第⑤步操作中可能发生反应的离子方程式:
;
(4)如何用最简单方法检验第⑤步实验是否达到了目的:
;
(5)你认为该设计里哪些步骤调换后不影响实验结果: ;
(6)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:
。
平达喜是常用的中和胃酸的药物,它的化学成分是可以表示为:MgxAly(OH)zCO3·nH2O,其中氢元素的质量分数为0.040。取该碱式盐30.1g,加热完全分解会产生标准状况下1.12L气体。加入2.0mol·L-1盐酸450mL使其正好完全溶解。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重17.4g。该试样中:
(1)碳酸根的物质的量;
(2)镁离子的物质的量;
(3)氢氧根离子的物质的量;
(4)碱式碳酸盐的化学式。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号