主族元素A、 B、C、D的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。回答下列问题:
B、C、D的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。回答下列问题:
⑴写出元素符号A_ ___,B__ __,C__ __,D_ ___。
⑵写出B与C在高温下完全反应后生成物的化学式______ __,电子式___ __ ,结构式___ ___。
⑶用电子式表示B、D在高温下形成的化合物的电子式_____ _ ___,判断其中的化学键的类型___ __ ___。
⑷写出一种有A、B、C、D组成的化合物的化学式___ ___。
常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198 g·mol-1,且其中各元素的质量比为:
钾 : 金属B : 氧=39 : 28 : 32。
请回答下列问题:
(1)Z的化学式为: ▲ 。
(2)写出检验X中阳离子的方法: ▲ 。
(3)写出E和A在高温下反应的化学方程式为: ▲ 。
(4)写出A和N反应的离子方程式: ▲ 。
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2CuCl2-+S
请回答下列问题:
⑴反应Ⅰ的产物为(填化学式) ▲ 。
⑵反应Ⅲ的离子方程式为 ▲ 。
⑶一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
▲ 。
⑷炼钢时,可将铁红投入熔融的生铁中,该过程中主要反应的化学方程式是 ▲ 。
⑸某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr 3++
3++  Fe3++ H2O(未配平)
Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ▲ 。
②反应Ⅳ所得气体中SO2的体积分数为 ▲ 。
(14分) 已知在下图转化关系(某些转化关系中的产物已略去)中都是中学化学常见的物质,物质A、D、G是单质,F是混合物,黑色物质C是某金属矿物的主要成份,有磁性,E是一种非氧化性酸,H是极易溶于水的碱性气体。
请回答下列问题:
⑴写出下列物质的化学式:A 、C 、I
⑵写出反应①的化学方程式:
⑶在一定温度、压强和有催化剂存在的条件下将1 mol G和2.5 mol D放入500mL密闭容器中。经过20min达到平衡,平衡后H的浓度为2mol/L,则用G表示20min内的平均反应速率为: ,该温度下此反应的平衡常数K= ,D的转化率为 。如果保持温度不变,再向容器中同时充入1.5 mol G和1 mol H,D的转化率将 (填“升高”、“不变”或“降低”),再次平衡后H的体积分数为 。
(6分)下列你所熟悉的物质中,甲、乙为两种金属单质,其中甲的合金用量最大;丙、丁为非金属单质,其中丁在常温下是黄绿色气体;A~E均为金属化合物。在适当的条件下,它们之间可以发生如下图所示的转化。
(1)NaOH的电子式为 ;组成单质丁的元素的原子结构简图为 。
(2)写出B与甲反应生成A的离子反应方程式  。
。
(3)写出乙与NaOH溶液反应的化学方程式 。
B、D、E为中学化学常见的单质,其中D、E为金属。在一定条件下C、D间能发生反应。各物质转化关系如下图:
(1)B的同素异形体的名称为:_____________;H的化学式为:_____________。
(2)已知1g E在氧气中燃烧放出的热量为Q kJ,试写出表示E燃烧热的热化学方程式_____________。
(3)用惰性电极电解A 溶液的阳极反应式为:_____________。
(4)检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________。
a.氯水和KSCN溶液 b.氢氧化钠溶液 c. 酸性KMnO4溶液
(5)用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入8.0g A的氧化物后恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________。
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两元素原子最外电子层上电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A和C可以形成化合物CA3;B与D的原子序数之比为3︰4;E原子最外层电子数比次外层电子数少1。请回答:
(1)E在元素周期表的位置为:_▲_
(2)A、B、C、D原子半径从大到小的顺序为:_▲_(填元素符号)
(3)由A、B两种元素组成的分子有多种,其中一种分子含4个原子,且分子为直线型的对称结构,写出其电子式_▲_。
(4)甲由A、B、C、D四种元素组成的无机盐,既可以与盐酸反应又可以与NaOH溶 液反应,其化学式为_▲_。
液反应,其化学式为_▲_。
(5)由A、C、E三种元素组成的化合物C2A6E2是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出该化合物第一步水解反应的离子方程式_▲_。
(6)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简单表示如下:
①将化合物CA3通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,写出该过程的总离子方程式_▲_。
②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为_▲_。
已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料。它们有如图所示的转化关系。
试回答下列问题
(1)X的化学式为: ;G的电子式为 。
(2)写出下列反应的化学方程式
① ② 。
(3)H与同周期原子序数比其大一的另一种金属组成原电池,H作正极,则负极反应式为 ,电解质溶液为 。
(4)H的工业制法可用电解原理,当阳极产生可使湿润的淀粉KI试纸变蓝的气体1.12升(标况)时,阴极生成H 克,有关化学方程式为 。
下图是一些常见单质、化合物之间的转化关系图。有些反应中的部分物质及反应条件被略去。A和B组成元素相同,在常温下都是无色液体。D和E的组成元素相同,I和K的组成元素相同,I在常温下是无色有毒气体,J是黑色粉末,G是一种红色金属单质。

(1)A的化学式是 ▲ 。
(2)B的电子式是 ▲ 。
(3)若D能使品红溶液褪色,且加热后溶液又恢复红色,则F和G反应的化学方程式为 ▲ 。
(4)若D是无色气体,且常温下遇空气变为红棕色气体,则J和F反应的离子方程式为 ▲ 。
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
(1)写出下列物质的化学式:
A: E: J: G:
(2)按要求写方程式:
①A与B生成C和D的化学方程式: 。
②F在空气中转化为G的化学方程式: 。
③I转化为J的离子方程式: 。
现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: C 、H
(2)写出反应③的化学方程式:
写出反应⑦的离子方程式:
(3)实验室检验物质G中阳离子的常用试剂是:
实验室检验物质D中阳离子的方法是
(14分) A、B、C、D是短周期元素形成的四种气体单质,甲、乙、丙、丁是化合物,其中化合物乙是离子晶体,D元素的原子最外层电子数是次外层的3倍,C的氧化性比D强,它们的转化关系如图所示(它们的生成物均给出,反 应条件略去)。
应条件略去)。
(1)写出分子式:A 、B 、
C 、D ;
(2)写出乙的阴离子水解的离子方程式: ;
(3)写出反应①、②化学方程式:① 、② ;
(4)举出实例说明单质C比D氧化性强(用化学方程式表示): 。
(5)A、C\、D与B反应生成的氢化物的沸点由高到低的顺序是 。
已知A为一无机盐,C 、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。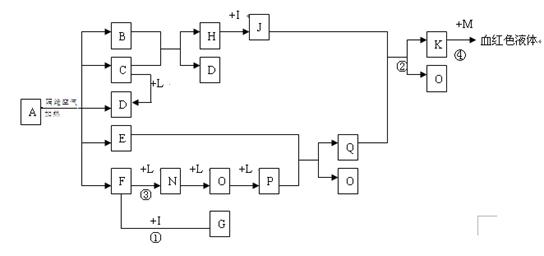
(1)写出G的电子式_______________,M的化学式_____________;
(2)写出反应②的离子反应方程式______________________________;
(3)写出反应③的化学反应方程式_____________;反应1-4中属于非氧化还原反应的是 ;
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极___________________
阳极___________________
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为B:C:D:E:F=1:2:2:2:2,写出A分解的反应方程式__________________________
(8分)有X、Y、Z、W四种在中学学过的固体化合物,实验现象如下:
①X、Y、Z、W的焰色反应均为黄色。
②在Z、W中加入稀盐酸,均有无色、无气味的气体放出。
③Y、Z、W分别与适量的Ba(OH)2浓溶液反应,均有白色沉淀生成;再加入过量盐酸,由Z、W生成的白色沉淀均溶解,由Y生成的白色沉淀不溶解。
④在相同条件下,将足量的Y的溶液分别加到相同物质的量浓度、相同体积的Z和W的溶液中,都有气泡出现。其中W溶液中气泡出现较快。
⑤X与CO2反应生成Z,同时生成另一种气体,此气体由地壳中含量最多的元素组成。
根据上述现象,回答下列问题:
(1)X的化学式为 ,Y的化学式为 ;
(2)写出下列有关反应的化学方程式或离子方程式。
①Z+石灰水(离子方程式) ;
②X+ CO2(化学方程式) ;
③W (化学方程式)
(化学方程式) 
 。
。
短周期中的A、B、C、D、E 5种元素,原子序数依次增大,A、D同主族;A、B 的原子序数之和等于C的原子序数;C2−离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数,
的原子序数之和等于C的原子序数;C2−离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数, 且D、E两元素能形成微粒个数比为1︰1的离子化合物。
且D、E两元素能形成微粒个数比为1︰1的离子化合物。
(1)E元素的离子结构示意图为________。
(2)A与B元素、A与C元素均可构成18电子的分子,其化学式分别为______、_______。
(3)A、C元素可组成原子个数比为1︰1的共价化合物乙,将E单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为 。
(4)A、B、C、D、E中的任意三种元素可组成多种化合物,X和Y是其中的两种。X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7。
将0.2mol·L−1的X溶液与0.1mol·L−1的Y溶液等体积混合后,溶液呈碱性。请判断:
①X的化学式为 ,Y的化学式为 ;
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为
。