短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX 3。已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子
3。已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子 数的2/3倍,试回答:
数的2/3倍,试回答:
(1)X、Y、Z元素的名称:X________Y___________Z__________( 各1分)
各1分)
(2) 用电子式表示ZX2的 形成过程______________________________________。
形成过程______________________________________。
(3)Y2X对应水化物的电子式______________(1分),其中存在的化学键有______________。
(4)写出Y2X溶于水的溶液与少量ZX2反应的化学方程式_____________________________。
根据提供条件推断元素,并按要求填空:
①原子核外有3个电子层,其价电子数为7,最高价氧化物化学式 ________ ,最高价氧化物对应水化物化学式 ________ ,其单质与NaOH反应的化学方程式为 ___________________________。
②短周期金属元素,最外层电子 数与电子层数相同。最高价氧化物与强酸反应的离子方程式为________________________________,最高价氧化物对应水化物与氢氧化钾反应的化学方程式为 _________________________________________。
数与电子层数相同。最高价氧化物与强酸反应的离子方程式为________________________________,最高价氧化物对应水化物与氢氧化钾反应的化学方程式为 _________________________________________。
③原子最外层电子数为电子层数三倍的非金属元素,与氢元素组成的化合物有两种,其电子式分别为_______、______,其单质也有两种,化学式分别为 ________、_______。(各1分)
④原子序数依次递增的四种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为 _______ 、 ________ 、 ________ 、 ________ 。(各1分)
短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)Y元素的名称是 。
(2)XZ3化合物的电子式是______________ 分子的立体构型
(3)分别写出X、Y的最高价含氧酸的分子式 、 。
X、Y、Z三种元素,X与氢气能形成气态XH4,其中X的质量分数为75%,且X与Y能形成XY2型化合物。Y的价电子构型为msmmpn, 且p轨道上仅有一对孤对电子。Z的最高价氧化物的水化物是酸性最强的酸。
且p轨道上仅有一对孤对电子。Z的最高价氧化物的水化物是酸性最强的酸。
(1)X元素所形成的同素异形体中硬度最大的是 (填名称)
(2)Y的氢化物分子的空间构型 ,熔化时 克服的作用力是 和
克服的作用力是 和
(3)Z元素位于周期表第 周期第 族,它的氢化物是  (填“极性”或“非极性”)分子。
(填“极性”或“非极性”)分子。
(4)X与Z形成的化合物其分子的空间构型是 电子式
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示。
请回答:
(1)写出B物质的化学式: ;F的名称: 。
(2)写出第③步反应的化学方程式为 。
(3)第④步反应中溶液颜色的变化 ;
写出第④步反应的离子方程式 。
(4)写出SO2和B反应的离子方程式 。
(5)F溶液中滴入NaOH溶液可能产生的实验现象是 。
A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);
试回答:
(1) 写出B在工业生产中的一种用途 。
(2)写出B转化为C的可能的离子方程式 。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理 。
(4)若C为钠盐,用含m mol C的溶液与1L n mol·L-1的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为 mol。
(5)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式 ;若负极材料消耗18g,则电池转移的电子总数为 。 (阿伏加德罗常数用NA表示)
A、D、E、M、L是原子序数依次增大的五种短周期元素。已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物。回答下列问题:
(1)元素D在元素周期表中的位置是 。
(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为 。
(3)由A、D组成的最简单化合物甲的二氯化物有 种。人们已经研究出以甲为燃料的新型碱性燃料电池,写出该电池正极的电极反应式为: 。
(4)已知反应:DE(g)+A2E(g) DE2(
DE2( g)+A2(g),
g)+A2(g),
一定条件下该反应进行过程中的能量变 化如上图表示,请结合上图判断:该反应△H 0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=
化如上图表示,请结合上图判断:该反应△H 0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=  。
。
(5)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为 。
(14分)已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
请根据以上情况,回答下列问题:
(1)含有元素A的盐的焰色反应为 。许多金属盐都可以发生焰色反应,其原因是 。
(2)C的氢化物分子的键角是 ,属于 分子。(填“极性”或“非极性”)
(3)BD3的中心原子的杂化类型是
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5的晶体类型为 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为____ ___。
物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含有一种溶质,G为酸,乙在G的浓溶液中发生钝化。有的反应可能在水溶液中进行,有的反应中生成物未全部给出,反应条件也未注明。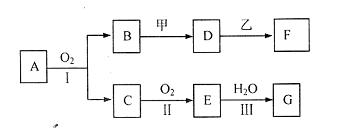
(1)若用两根玻璃检分别蘸取A、G的浓溶液并使它接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
①1.7gA与O2反应生成气态的B和C时放出22.67J热量,写出该反应的热化学方程式 。
②D与乙反应的离子方程式是 。
③D的水溶液和F的水溶液中由水电离出的c(OH—) (填字母序号)。
(a)前者大 (b)后者大 (c)一样大 (d)不知浓度,无法比较
(2)若B为红棕色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应I在 中进行,反应III在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③D和乙反应的离子方程式是 。
已知A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出下列元素的元素符号
A: C: E: (各1分)
(2)画出 E的阴离子结构示意图: (1分)
E的阴离子结构示意图: (1分)
(3)A的单质和C的单质在一定条件下生成化合物X,用电子式表示X的形成过程 ;向X的水溶液中滴入酚酞溶液,会观察到
(4)将9克B的单质在足量的D的单质中燃烧,所 得气体通入1L
得气体通入1L  1mol·L-1
1mol·L-1
NaOH溶液中,完全吸收后,溶液中大量存在的溶质是 ,
且物质的量为 (各2分)
(14分)J、L、M、 R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T周期表中位于第___族。
(2)J和氢组成的化合物分子有4个原子,其结构式为____ __ 。
。
(3)M和T形成的化合物在 潮湿的空气中冒白色烟雾,反应的化学方程式为___ __。
潮湿的空气中冒白色烟雾,反应的化学方程式为___ __。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_ __ ___。
②由甲与氧气、KOH 溶液构成原电池,负极会产生L的单质。则其负极反应式为__________________________ ____。
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为____ ____。
甲、乙、丙、丁是四种短周期元素,乙原子有三个电 子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子
子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子 数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲是 元素(填元素符号),甲的单质与水反应的化学方程式为 ;
(2)乙是 元素(填元素符号),原子结构示意图为 ;
(3)丙是 元素(填元素名称),最高价氧化物对应水化物的化学式是 ;
(4)丁是 元素(填元素名称),甲与丁两种元素可组成的物 质有 、
质有 、
。(填化学式)
A、B、C、D是四种常见的单质,A、B均为金属;C、D常温下均是气体。甲、乙、丙、丁、戊、己为六种常见的化合物。它们之间有如图所示的转化关系:
请回答下列问题:
(1)B与甲反应的化学方程式是 。
(2)用等质量的B单质以及盐酸、氢氧化钠溶液为原料,制取等质量的己化合物,请你选择出最佳的制取方案,写出该方案有关的离子方程式 。你确定该方案最佳的理由是 。
(3)电浮选凝聚法是工业上采用的一种污水处理方法,图中是该方法处理污水的实验装置示意图,使用金属A、B为电极,实验过程中,污水的PH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。
阳极的电极反应式分别是 、2H2O-4e-=4H++O2↑
阳极区生成沉淀的离子方程式是 。
A、B、C、D、E、F六种物质,一定条件下有如下图所示的转化关系(所有的反应物和生成物均已给出):
(1)若①、②、③均为水溶液中的置换反应,且A、D、E是常见的卤素单质,B、C、F为化合物。则A、D、E的氧化性由强到弱的顺序为 (用字母表示),其中A的化学式为 (用元素符号表示)。
(2)若B是一种淡黄色固体,绿色植物的呼吸作用和光合作用可实现自然界中D和E的循环,则F的化学式为 ;反应①的离子方程式是 。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是 ;反应③是某些氮肥厂获得合成氨原料D的一个重要反应,假设反应后的气体中只有F和D,从综合经济效益的角度考虑,简述如何从反应后的混合物中分离出D。 。