① A、B、C、D四种物质均含有元素X,有的还可能含有元素Y或者Z。元素Y、X、Z的质子数依次递增。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热催化分解,可制得元素Y的单质。请回答下列问题 :
:
(1) 写出元素X、Z的元素符号:X: ,Z ;
(2) 写出A、C的化学式:A ,C ;
(3) 写出③中反应的化学方程式 ;
(4) 写出④中反应的化学方程式 。
下列为A、B、C、D四种物质的转化关系,a、b为反应条件,
(1)若A为单质,a为点燃,b为催化剂、加热,则A为 (填写化学式),
写出B→C的方程式 。
(2)若A为气态化合物,B→C转化不需要条件,则A为 (填写化学式),
写出A→B化学方程式  。
。
写出Cu+D溶液→B的离子方程式 。
(3)把某黑色固体Y加热至红热,投入到上述某种无色溶液D中产生两种气体组成的混合气体X,将X做如下所示实验:
写出M、G所代表物质的化学式 M G
如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)
(1)写出下列物质的化学式:A________ F________ 甲_______ 丙________
(2)写出下列反应的化学方程式:A与B ______________________________
Cu与H ________________________________
(3)写出丙与D溶液反应的离子方程式 ________________________________
(4)常温时H的浓溶液与丙物质并不能看到明显的反应现象,原因是
。
已知有以下物质相互转化,其中A为单质
试回答:
(1)写出下列物质的化学式:
A  ;B ; H ;F
;B ; H ;F
(2)写出由A转变成B的离子反应方程式 
(3)写出用KSCN溶液鉴别G溶液的离子方程式
(4)写出G溶液加入A的有关离子反应方程式
已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示。
(1)请根据以上关系进行判断,指出下列物质的化学式:
A ,C ,D , G .
(2)写出下列反应的化学方程式:
C+D: ;
A+B: 。
在A和B的反应中,A显示出来的性质是 (填写序号,多选倒扣)。
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性
(3)C还能由以下反应制得:KClO3+6HCl=KCl+3Cl2↑+3H2 O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为 。
O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为 。
(每空3分,共15分)原子序数依次增大 的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两
的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两 种氧化物。
种氧化物。 (1)W元素在元素周期表的位置为
(1)W元素在元素周期表的位置为  ,用电子式表示其气态氢
,用电子式表示其气态氢 化物 。
化物 。 (2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
。 (3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是
 。
。
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为 。
短周期元素形成的纯净物A、B、C、D、E是转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一种化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因。
。
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是 。
③已知常温下物质A与物质B生成1mol气体C的△H为-57.07kJ·mol-1,1 mol气体C与H2O反应生成D溶液和E气体的△H为-46kJ ·mol-1,写出物质A与物质B及水生成D溶液的热化学方程式 。
(13分) A~L均为化学实验室中常见的物质,它们有以下转化关系。其中:I是一种黄绿色有毒气体,B、D、E、G均为家庭中常见的物质,常温下,B为无色液体,L是一种具有水果香味的液体。试回答下列问题
(1)A的名称: C的电子式:
(2)写出反应①的化学反应方程式
写出反应②的离子方程式
(3)实验室以E为原料制取一种植物生长调节剂的化学方程式为: .
A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的单质是自然界最轻的气体,E单质须保存在煤油中。A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)N的电子式为 ;M分子中含有 (填“极性”或“非极性”)键
(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式
反应后水溶液显 (填“酸”“碱”或“中”)性,原因是 (用离子方程式表示)
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质。则其负极反应为 ;一段时间后,溶液pH (填“增大”“减小”或“不变”)。 (5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是 (选填序号字母)。
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质
已知A、Y为常见金属单质,且Y是短周期元素,Z既可溶于盐酸,又可溶于氢氧化钠溶液。根据下图回答问题: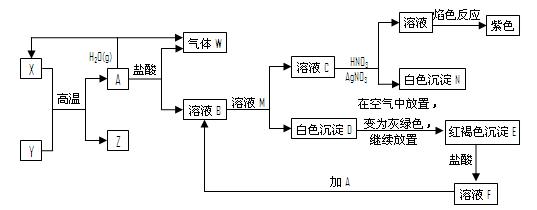
(1)Y在元素周期表中的位置 。
(2)Z与氢氧化钠溶液反应的离子方程式为 。
(3)B与M反应的化学方程式为 。
(4)A与水反应的化学方程式为 。
(5)检验溶液F中阳离子的方法是 。
(6)W气体可作燃料电池的原料,则在碱性介质中,W所在极的电极反应为 。
(7)在沸水中加入F溶液的离子方程式为 。
由单质A与化合物B两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:
请回答:
(1)A的化学式 ;B的俗称 ;J的化学式
(2)反应③的离子方程式
(3)反应②的离子方程式
(4)沉淀H变沉淀I的化学方程式
(5)如何检验溶液F中的阳离子
有关元素X、Y、Z、W的信息如下:
请回答下列问题:
(1) Y的单质在空气 中充分燃烧所得氧化物的电子式________________
中充分燃烧所得氧化物的电子式________________
(2) X、Y、W的简单离子的半径由大到小的是_______________ (写离子符号)
(3) 向淀粉碘化钾溶液中滴加几滴 的浓溶液,现象为______________ ,
的浓溶液,现象为______________ , 基态离子的电子排布式为
基态离子的电子排布式为
(4) 以 溶液为原料制取无水
溶液为原料制取无水 ,主要操作包括加热浓缩、冷却结晶、过滤,先制得
,主要操作包括加热浓缩、冷却结晶、过滤,先制得 晶体,然后在条件下加热
晶体,然后在条件下加热 晶体,能进一步制取无水
晶体,能进一步制取无水 .其原因是(结合离子方程式简要说明) _____________________________________________
.其原因是(结合离子方程式简要说明) _____________________________________________
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素元素的符号是__________;,其最高正价为_______;
(2)Y元素位于周期表中位置是:________周期________族;
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子。回答:
(1)上述六种元素按电负性从小到大的排列是 (写元素符号)。
(2)C、D、E、F元素第一电离能最大的是 (写元素符号)形成的最高价氧化物对应水化物中,酸性最强的是 碱性最强的是 呈两性的是分别是 (写化学式)
已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:
(1)写出化学式:A____________;E______________;L______________。
(2)反应①的离子方程式:___________________________________。
(3)反应②,工业上采取的反应条件是________________________。
(4)反应③,工业上采取的操作不是K直接与H反应,原因是__________________。
(5)每生成1 mol K, 反应放出98.3 kJ热量,该反应的热化学方程式为:
反应放出98.3 kJ热量,该反应的热化学方程式为:
___________________________________________ ________________________。
________________________。