常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198 g·mol-1,且其中各元素的质量比为:
钾 : 金属B : 氧=39 : 28 : 32。
请回答下列问题: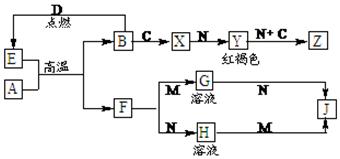
(1)Z的化学式为: ▲ 。
(2)写出检验X中阳离子的方法: ▲ 。
(3)写出E和A在高温下反应的化学方程式为: ▲ 。
(4)写出A和N反应的离子方程式: ▲ 。
常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198 g·mol-1,且其中各元素的质量比为:
钾 : 金属B : 氧=39 : 28 : 32。
请回答下列问题:
(1)Z的化学式为: ▲ 。
(2)写出检验X中阳离子的方法: ▲ 。
(3)写出E和A在高温下反应的化学方程式为: ▲ 。
(4)写出A和N反应的离子方程式: ▲ 。