医生建议患甲状腺肿大的病人多食海带,这是由于海带中含有丰富的 ;
碘缺乏病是目前已知的导致人类智力障碍的主要原因。为解决这一全国性的问题,我国已经开始实施“智力工程”,最经济的可行措施是 。
通常采用NaHCO3的悬浊液除去混在CO2中的少量HCl气体,其反应的离子方程式是___________________,不用NaOH溶液的原因是________________________________,反应的离子方程式是_______________________________;也不用饱和Na2CO3溶液的原因是_________________________________,其离子方程式是______________________________。
碘缺乏症遍及全球,多发生于山区。南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者大约有1000万人。为控制该病的发生,较为有效的方法是食用含碘食盐,我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为 。氧化产物与还原产物的物质的量之比为 。能观察到的明显现象是 。
(4)已知KIO3可用电解方法制得。总反应化学方程式为:KI+3H2O KIO3+3H2↑。在某温度下.若以12 A的电流强度电解KI溶液10 min.理论上可得标况下氢气___________L。
KIO3+3H2↑。在某温度下.若以12 A的电流强度电解KI溶液10 min.理论上可得标况下氢气___________L。
(1)一种变色眼镜的镜片和普通照相感光胶片中含有卤化银。镜片变化是因为卤化银在光的作用下发生化学反应,其反应式是 ,照相感光胶片曝光的化学反应是
。
(2)在我国干旱严重的华北地区,近年来利用飞机、高炮或火箭等运载工具向过冷支层中播撒碘化银(AgI)或干冰,实现人工增雨(或人工增雪),达到减灾的目的。下列有关人工增雨的评述中,你认为不甚理智的是
| A.它对农业生产条件和大气环境的改善有一定的效益 |
| B.它使用的碘化银中的重金属元素对土壤造成污染 |
| C.它使用的AgI如换成干冰,可避免重金属元素对土壤的污染 |
| D.它是人类彻底战胜自然的表现,体现了人类的力量是无穷的 |
A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出,根据不同信息分别完成(1)(2)两个小题。
 |
(1)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为 (填写相应的字母),其中A的化学式是 。
(2)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。反应①的化学方程式是 。在反应③中,若生成1 mol D,则转移电子的数目为 。
向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察下图所记录的现象,判断各瓶注入的液体是什么,将注入液体的编码填入图下方相应的括号中。
A.AgNO3溶液B.NaOH溶液C.水
镁不仅能在O2中燃烧,它还能在不支持燃烧的氮气、能灭火的CO2中燃烧。与CO2性质相似,镁亦能在SO2和灼热的水蒸气中燃烧,写出有关反应的化学方程式并指出实验时观察到的现象。
(1)Mg+SO2
①反应方程式:_______________;②实验现象:_______________。
(2)Mg+H2O(g)
①反应方程式:_______________;②实验现象:_______________。
某NaBr、NaI混合液中,含NaBr 0.1mol,NaI 0.2mol。通入vL(标准状况)氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质。
当v的取值范围为0<v<2.24L时,固体剩余物质成分是 ;
当固体剩余物质成分是NaCl时,v的取值范围为 ;
当固体剩余物质成分是NaCl和NaBr时,v的取值范围为 。
按下面的实验过程填空:
写出上述反应的化学方程式:
(1)_________________________________________________________
(2)_________________________________________________________
(3)_________________________________________________________
(15分)我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
⑴一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式______________________。
⑵为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程:
已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是_____________,原料A最好是下列物质中的____________。
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
②写出上述工艺中投入氢氧化钠时反应的离子方程式:
______________________________________________________。
③写出上述工艺中稀释时发生水解反应的化学方程式:
______________________________________________________。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为 ;
(2)写出反应⑥的化学方程式 ;
(3)写出反应④的离子方程式 ;
(4)写出反应③阳极的电极反应式 ;
(5)反应①中每生成3molA,转移电子的物质的量为 。
在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A溶液和酸G中,且H为良好的耐火材料(图中部分产物没有列出)。
(1)写出M和过量的固体甲反应的化学方程式:
(2)如图表示的是生产酸G的工业流程:
①设备乙的名称为 ;
②气体X的主要成分为 ;
③写出设备甲中常见的化学反应 ;
(3)固体乙与M反应的化学方程式为 。
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下: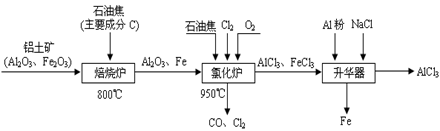
(1)已知:C(s)+O2(g)=CO(g);△H=-110.5kJ·mol-1 ①
2Fe(s)+O2(g)=Fe2O3(s) ;△H=-822.1kJ·mol-1 ②
请写出C还原Fe2O3生成CO的热化学方程式:
。
(2)氯化炉中通入O2的目的是 。
(3)氯化炉中Al2O3、C12和C反应的化学方程式是 。
(4)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式 。
(5)在升华器中加入铝粉的目的是 。
(9分)已知X、Y、Z是阳离子,K是阴离子,M、N是分子。它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失。
回答下列问题:
(1)Y的化学式为 ;N的电子式为
(2)试比较M和N的稳定性:M (填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式: ;
(4))上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
①写b出阶段的离子方程式:
②根据图像判断该盐的化学式为 。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第_____周期、第_____族;
(2)写出反应①的化学方程式______________________________________________;
(3)写出反应④的离子方程式______________________________________________;
(4)写出反应③的电极方程式:
阳极:_______________________ 阴极:___________________________
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)