按下面的实验过程填空: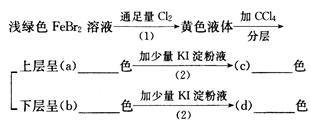
写出上述反应的化学方程式:
(1)_________________________________________________________
(2)_________________________________________________________
(3)_________________________________________________________
按下面的实验过程填空:
写出上述反应的化学方程式:
(1)_________________________________________________________
(2)_________________________________________________________
(3)_________________________________________________________