铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。回答下列问题。
(1)FeCl3溶液吸可以吸收烟气中的SO2,该反应的离子方程式是________________。
(2)已知反应:3Br2 + 6FeCl2 = 4FeCl3 + 2FeBr3,向1L 0.4mol/L的FeBr2溶液中通入6.72LCl2(标准状况),写出该反应的离子方程式(用总方程式表示)______________________
(3)已知铁的某种氧化物化学式为FexO(x<1),铁元素的质量分数为76.3%,则FexO中x值(精确至0.01)为 ______,该氧化物中的Fe分别为Fe2+、Fe3+,计算n(Fe2+):n(Fe3+)= _________
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe  H2
H2 Cu,②CuO
Cu,②CuO  CuSO4
CuSO4  Cu。
Cu。
若实验过程中,根据规范的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是__________
| A.相等 | B.①多 | C.②多 | D.无法判断 |
(5)在铁与铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1 g;再向其中加入一定量稀硫酸,充分振荡后,剩余金属m2 g,则m1________(填“大于”、“可能大于”、“等于”或“可能等于”)m2
(6)以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4molFe(OH)3沉淀,此间共消耗的水的物质的量为_______mol
(14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:
请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;该反应的化学方程式为 ___________________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式_________________
A、B、C、D、E为五种短周期元素。A、B、C是原子序数递增的同周期元素,且最外层电子数之和为15,A与C可形成常见的AC2分子;D元素的某种原子中无中子;E是地壳中含量最高的金属元素。请回答下列问题:
(1)AC2分子的电子式为____________________。
(2)比较BD3与D2C的稳定性:_______比________稳定(填化学式)。
(3)五种元素的原子半径由大到小的顺序是__________________(填元素符号)。
(4)E的单质与NaOH溶液反应生成的盐的溶液与少量AC2反应的离子方程式为___________________。
(5)化合物EB溶于强碱生成氨气,写出EB与NaOH溶液反应的化学方程式______________________。
(6)工业生产的EB产品往往含有碳和氧化铝杂质,现取10 g样品置于反应器中,通入2.016L(标准状况下)O2,在高温下充分反应后,所得气体的密度是相同状况下氢气的15倍(EB不与O2反应)。该样品中含杂质碳的质量分数为______________。
(8分) 元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体。
(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1。
①这样的两种元素的组合有________种。
②若这样的两种元素形成的化合物中原子数之比为1∶1。
写出其中一种化合物的名称:____________________________;
(2)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示:
请回答下列问题:
①F的化学式为_______ _,D的电子式为________________
②E与水反应的化学方程式为________________________________;
③实际生产中,可由F为原料制备单质A,写出制备过程的化学方程式(不需考虑综合经济效益)
(12分)海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示:
(1)工业制取镁的方法是 法。
(2)试剂Ⅰ一般选用 (填化学式)。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K 时的稳定状态)。
①由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式 。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式 。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中常用固体E在B的催化下加热制取气体单质H。
请回答下列问题:
(1)反应①的化学方程式为____________________
(2)反应②的离子方程式为____________________
(3)写出另外一种实验室制取H的化学方程式_______________________
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的KSP=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合。若D的浓度为1×10-2mol/L,则生成沉淀所需Pb(NO3)2溶液的最小浓度为_______
(13分)已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素。
(1)五种元素中,非金属性最强的元素在周期表中的位置是__________________,写出C元素的原子结构示意图____________________。
(2)B元素的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在化学键的类型为___。
(3)C元素的最高价氧化物对应的水化物与D元素的最高价氧化物反应的化学方程式为_____________。
(4)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示转化关系。
①X、Y、Z均含有同一种金属元素,若w固体俗称干冰,则反应Y→Z的离子方程式为__________;若w是强碱,且Y为白色难溶固体,则反应Z→Y的离子方程式为________________________。
②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式为_______________________________。
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下:
请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式: 。
(2)将过程②中产生的气体通入下列溶液中,溶液会腿色的是 。
| A.品红溶液 | B.紫色石蕊试液 | C.酸性高锰酸钾溶液 | D.溴水 |
(3)过程③中,需要加入的物质是 (化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有 。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是 。
(1)二氧化硅与碳高温下反应的化学方程式为
上述反应中生成的单质有什么用途: (写一条即可)。卞石是硅酸盐,不同类型的卞石中氧原子的物质的量分数相同,由钠卞石化学式NaAlSi3O8可推知钙卞石的化学式为 ,请将钠卞石的化学式改写成氧化物的形式:
(2)天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
COS Na2S溶液
Na2S溶液 H2 羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
H2 羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
(Ⅰ)某盐有原子序数处于前20的三种元素组成,相对分子质量为98,其焰色反应为紫色(透过蓝色的钴玻璃)。向此溶液中滴入少量盐酸时,产生白色沉淀,继续加入过量盐酸时,白色沉淀消失,再滴入过量氨水,又产生白色沉淀。
(1)三种元素中原子序数最小的简单离子的离子结构示意图 ,
(2)该盐的化学式为 ,
(3)该盐溶液滴入少量盐酸的离子方程式 。
(Ⅱ)某二元化合物A是一红棕色难溶物质,温度超过60℃,分解生成红色金属B和无色气体单质C,且两种单质的物质的量之比为2:1,将A与盐酸反应也同样产生气体C。在一定条件下可以用H3PO2与CuSO4溶液混合制备A,经鉴定反应后的溶液是磷酸和硫酸的混合物。且A能在氯气中燃烧。
(1)A的化学式为 ,
(2)写出用H3PO2与CuSO4溶液混合制备A的反应方程式 ;
(3)写出A在氯气中燃烧的方程式 ;
(4)有人认为还有一种组成元素与A相同的二元化合物, 若此物质为离子化合物,则电子式为 ;
(5)A与盐酸能反应的原因 。
海水是巨大的资源宝库.如图1是从海水中提取食盐和溴的主要流程.

(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.如图2是粗盐提纯的操作流程.

提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液.
①除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、
②如何证明操作①中NaOH溶液已经过量?
③蒸发过程所用的主要仪器有:铁架台、酒精灯、 、 ;
(2)某同学欲四氯化碳萃取较高浓度的溴水中的溴,经振荡并在铁架台上静置分层后,分离出四氯化碳层的操作:
(3)工业上将较高浓度的溴水经进一步处理得到工业溴.某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃,微溶于水,有毒性和强腐蚀性.水的沸点为100℃.他们参观生产过程后,设计了如图3装置简图:

①图中仪器B的名称: ②温度计水银球的位置:
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为:
金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质。
(1)钠与水反应时,钠漂浮在水面上。甲同学用刺有小孔的铝箔将4.6g的钠包裹,而后投入到水中,使钠沉入水底与水(足量)反应。该过程中发生反应的离子方程式有___________,充分反应生成的气体体积_________(填“大于”、“小于”或“等于”)2.24L(标准状况下)。
(2)乙同学将足量的铜粉投入到500mL18.4mol/L的浓硫酸中并加热制取SO2,写出该反应的化学方程式__________,生成的SO2物质的量小于4.6mol的原因是_____________。
(3)丙同学向MgCl2、AlCl3的混合溶液中逐滴滴加2mol/L的NaOH溶液,并绘制出沉淀与NaOH溶液体积的关系图像如图,则a=_________,b=________。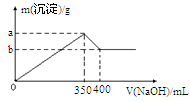
海藻中富含碘元素。某小组同学在实验室里用灼烧海藻的灰分提取碘,流程如下图。
(1)写出操作名称:操作① ,操作③ 。
(2)用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4。有关化学方程式为:
碱性条件,3I2+6NaOH=5NaI+NaIO3+3H2O,
酸性条件,5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+H2O。
以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的 (填仪器名称)中加入少量1mol·L-1 NaOH溶液;
②振荡至溶液的 色消失,静置、分层,则 (填“上”、“下”)层为CCl4;
③将含碘的碱溶液从仪器的 (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1 mol·L-1 H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体;
(3)本实验中可以循环利用的物质是 。
香料Ⅴ的制备方法如下:
(1)化合物I的分子式为 ,Ⅳ中含氧官能团的名称是 。
(2)化合物I可由 经两步反应制得,写出第一步反应的化学方程式 。
经两步反应制得,写出第一步反应的化学方程式 。
(3)1mol的化合物II和Ⅲ分别与H2反应,最多消耗H2的物质的量之比为 。
(4)该工艺中第①步的目的是 。为检验①中CH3I的碘原子,实验室的操作是:取少量CH3I于试管中,加入足量的NaOH水溶液,加热充分反应,冷却后加入 ,再加入少量硝酸银溶液。
(5)芳香化合物Ⅵ是Ⅲ的一种无甲基同分异构体,能发生水解反应和银镜反应,Ⅵ的结构简式为 。
(6)一定条件下,化合物Ⅳ与乙二醇发生类似反应④的反应,该有机产物的结构简式为 。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________, X属于的晶体类型是_________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中发生的离子反应方程式为______。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为______ g