某化学小组按下图所示实验流程比较浓硝酸和稀硝酸的氧化性强弱,其中B为一种紫红色金属,C为红棕色气体。

请回答下列问题:
(1)A与B反应的化学方程式是 ;A与B反应迅速,实验中需要采取措施控制气体放出的快慢,则装置Ⅰ所选择的主要仪器为 (不包括铁架台、铁夹、橡皮塞和导管等)。
(2)实验时在装置Ⅰ中加入B后,在加入A之前需向整套装置中通入足量的CO2气体,该操作的目的是 。实验室制取CO2气体的化学方程式是 。
(3)装置Ⅱ中发生反应的化学方程式是 。
(4)通过实验可得出:浓硝酸的氧化性比稀硝酸 (填“强”或“弱”),判断的依据 是 。
(5)小组内有同学指出该流程中装置Ⅴ可有可无,你认为装置Ⅴ是否需要 (填“是”或“否”),理由是 。
如下图所示装置,若将胶头滴管中的水挤入集气瓶中,请描述观察到的现象并写出有关的离子方程式。

(1)A中的现象为 ,
离子方程式 。
(2)C中的现象为 ,
离子方程式 。
(3)E中的现象为 ,
离子方程式 。
(4)G中的现象为 ,
离子方程式 。
Ⅰ.下列实验操作中,叙述正确的是 (填字母)
| A.用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏小 |
| B.过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌 |
| C.分液时,分液漏斗中下层液体从下口放出后再将上层液体从下口放出到另—烧杯 |
| D.做焰色反应的铂丝,用硫酸洗涤后,再在酒精灯火焰上灼烧至无色,才可使用 |
E.向溶液中加盐酸酸化的BaCl2 ,如果产生白色沉淀,则一定有SO
F.证明某盐中含有NH4+的方法是:取该盐加入强碱溶液加热,如果产生使湿润的蓝色石蕊试纸变红的气体,便证明有NH4+
G.使用容量瓶配置一定浓度的溶液时,俯视刻度线定容后所得溶液的浓度偏高
H.用灼烧法鉴别棉织品和毛织品,有焦臭味的是毛织品
Ⅱ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________ .
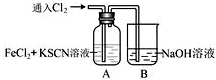
(3)资料显示:SCN -的电子式为  .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN﹣中被氧化的元素是 .
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
a mol FeS与b mol FeO投入到v L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④[cV-(9a+b)/3 ]mol
| A.①④ | B.②③ | C.①③ | D.②④ |
把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是
| A.氧气 | B.二氧化氮 |
| C.二氧化氮和氧气 | D.二氧化氮和一氧化氮 |
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示),已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。 若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )

| A.只用盐酸一种试剂就可以确定该固体M的具体成分 |
| B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3 |
| C.常温时用pH试纸检验,若pH=7,则固体M一定是Na2SO4 |
| D.往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4 |
3.2g铜与过量的硝酸(8mol/L,30mL)充分反应,硝酸的还原产物是NO和NO2,反应后溶液中含有amolH+,则此时溶液中含有NO 3 - 的物质的量为 ( )
| A.(0.2+a)mol | B.(0.1+a)mol | C.(0.05+a)mol | D.a mol |
将甲气体通入BaCl2溶液,未见沉淀生成,然后通入乙气体,有沉淀生成,则甲、乙气体不可能是 ( )
| A.SO2、H2S | B.SO2、NO2 | C.NH3、CO2 | D.CO2、SO2 |
将5.6g铁投入浓硝酸溶液中,产生红棕色气体A,把所得溶液减压蒸干,得到20gFe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为
A.1120mL B.2240mL C.336mL D.4480mL
下列说法不正确的是
| A.MgO的熔点高,可用做防火板材料 |
| B.BaC03与盐酸反应,可用于治疗胃酸过多 |
| C.臭氧有强氧化性,可用于餐具消毒 |
| D.NH3易液化,可用作制冷剂 |
工业生产中物质的循环利用有多种,例如:
下列表示不正确的是
| A.图Ⅰ可表示合成氨,其中N2、H2被循环使用 |
| B.图Ⅱ可表示电解熔融的MgCl2得到镁,其中HCl循环使用 |
| C.图Ⅲ可表示氨催化氧化法制硝酸,其中NO循环使用 |
| D.图Ⅰ可用于侯氏制纯碱CO2的循环利用 |
下列关系中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
A B
B C
C D
D E
E F
F
下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B与Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
在无机化工中,硫酸亚铁铵[(NH4)2Fe(SO4)2]是制取其它铁系化合物的原料,如制取氧化伯系颜料、磁性材料和黄血盐等。某化学兴趣小组设计如下实验方案,探究(NH4)2Fe(SO4)2完全分解的产物。
已知:①隔绝空气受热完全分解是氧化还原反应。
②98%浓硫酸能顺利吸收SO3。
Ⅰ.甲同学根据以下流程探究分解的部分产物,试回答下列问题: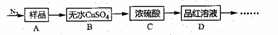
(1)B装置预期的现象是_____;C装置的作用可能是______,D装置可以检验分解产物中是否含有_____。
(2)加热前先通一会儿N2,再关闭气阀,其目的是_______。
Ⅱ.乙同学猜想(NH4)2Fe(SO4)2分解时可能生成了SO3,为了验证他的猜想,小组同学又提供了如右图装置,试回答下列问题:
(3)不能选择E和F装置的原因是________。
(4)加热装置A与G、H连接并进行实验,请你提出需要改进的方案________。
(5)已知饱和SO2水溶液中c(SO32-)=6.0×10-8mol•L-1,Ksp(BaSO3)=5.4×10-7。通过计算判断在1.0mol•L-1的BaCl2溶液中,通入足量纯净的SO2能否生成BaSO3沉淀?
(6)当G中出现大量白色沉淀时,并不能说明A中生成了SO3,理由是_______;为了进一步证明是否有SO3生成,请你补充实验方案(不要求写具体的操作过程)_________。
雾霾天气严重影响人们的生活,氮氧化物和硫氧化物是造成雾霾的主要原因之一。
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。
(1)某同学测得该样本所含水溶性无机离子的化学组分及其平均浓度列出下表:(若缺少的离子用H+或OH-补充):
| 离子 |
K+ |
Na+ |
NH4+ |
SO32- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
7×10-6 |
3×10-6 |
2×10-5 |
3×10-5 |
5×10-5 |
2×10-5 |
根据表中数据判断该试样的pH=_______;该表有一处笔误,请你指正_____________________。
Ⅱ.消除氮氧化物和硫化物有多种方法。
【方法一 】:工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4(连二亚硫酸钠)和NH4NO3产品的流程图如图1(Ce为铈元素):

(2)装置Ⅰ中的主要反应的离子方程式为_____________________________。
(3)装置Ⅲ可以使Ce4+中再生,若用甲烷燃烧电池电解该装置中的溶液,当消耗24g甲烷时,理论上可再生______________mol Ce4+。
(4)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,
该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7.求吸收液中的SO32-的浓度_____________。(结果保留2位有效数字)
【方法二 】:NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图2所示:

(5)图乙是不同催化剂Mn和Cr在不同温度下对应的脱氢率,由图综合考虑可知最佳的催化剂和相应的温度分别为____________。
(6)用Fe做催化剂时,在氨气足量的情况下,不同 =1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为_____________________。
=1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为_____________________。
【方法三 】用活性炭还原法可以处理氮氧化物。
反应原理:1/2C(s)+NO(g) 1/2N2(g)+1/2CO2(g) △H=-QkJ/mol
1/2N2(g)+1/2CO2(g) △H=-QkJ/mol
在T1℃时,反应进行到不同的时间测得各物质的浓度如下:

(7)T1℃时,该反应的平衡常数K=_________________________。
(8)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是______。