用浓氯化铵溶液处理过的舞台幕布不易着火,其原因是( )
①幕布的着火点升高 ②幕布的质量增加 ③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
| A.①② | B.②③ | C.③④ | D.②④ |
下列变化不属于氮的固定的是( )
| A.工业合成氨 |
| B.雷雨闪电时,大气中产生了一氧化氮 |
| C.豆科作物的根瘤菌将空气中的氮转化为氨 |
| D.在一定条件下由氨气和二氧化碳合成尿素 |
对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+等微粒)。分别进行如下实验:(1)加热,放出的气体可以使品红溶液褪色;(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。对于下列微粒不能确认其在原溶液中是否存在的是( )
| A.Br- | B.SO42- | C.H2SO3 | D.NH4+ |
Ⅰ.(1)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。理论上硫酸和硝酸的物质的量之比最佳为:_____________
(2)实验上,即使铜粉、硫酸及硝酸都比较纯,制得的CuSO4·5H2O中还是可能存在杂质,除去这种杂质的实验操作称为___________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加M调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol•L-1,就认为沉淀完全)然后过滤、浓缩、结晶。
请回答下列问题:
①方案甲中,钢丝应在__________中反复灼烧;(填仪器名称)
方案丙:将钢丝放到一定量的稀硫酸中,加入适量的H2O2,并控制温度在50℃~60℃,持续反应1h,也能获得硫酸铜。请回答下列问题:
②反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是______________________;
Ⅱ.用湿法制磷酸的副产品氟硅酸(H2SiF6)生成无水氟化氢的工艺如下图所示: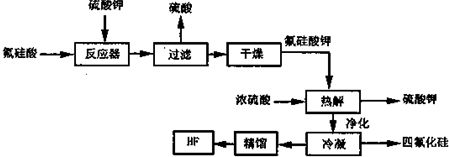
已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于醇.在热水中水解成氟化钾、氟化氢及硅酸.
(1)写出反应器中的化学方程式:____________________________。
(2)在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤而不是用水,其目的是:_________________。
(3)该流程中哪些物质可以循环使用:____________________________。
(4)为了测定无水氟化氢的纯度,取标况下的气体产物2.24L,测得质量为3.1g,试解释,为什么标况下2.24L产物的质量远远大于2.0g,____________________________。
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度 /mol.L-1 |
4×10-5 |
6×10-5 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性,试样的pH=_________。
Ⅱ.NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
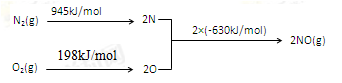
①N2(g)+O2(g) 2NO(g)△H=________。
2NO(g)△H=________。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式___。
2CO(g)═2C(s)+O2(g),已知该反应的△H>0,该设想不能实现,他的依据是_______。
Ⅲ.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
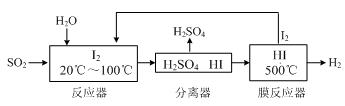
①用离子方程式表示反应器中发生的反应___________________________。
②用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
NiO(OH)+MH,电池放电时,负极电极反应式为:________________________。
用试纸检验气体性质是一种重要的实验方法,如下表所示的实验中(可加热),下列试纸的选用、现象及对应结论均正确的一项是( )
| 选项 |
试剂 |
湿润的试纸 |
现象 |
结论 |
| A |
Na2SO3,浓硫酸 |
品红试纸 |
褪色 |
SO2具有漂白性 |
| B |
浓氨水,生石灰 |
蓝色石蕊试纸 |
变红 |
氨气为碱性气体 |
| C |
碘水 |
淀粉试纸 |
变蓝 |
碘具有氧化性 |
| D |
Cu,浓硝酸 |
淀粉-KI试纸 |
变蓝 |
NO2为酸性气体 |
合成氨反应是化学上最重要的反应:
(1)合成氨原料气中的氢气可利用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2 mol CO2吸收316kJ热量,该反应的热化学方程式是_______________________,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是________________。
(2)已知N2(g)+3H2(g) 2NH3(g) ΔH<0。下图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
2NH3(g) ΔH<0。下图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是________。
②关于工业合成氨的反应,下列叙述正确的是________(填序号)
| A.上图中M、N、Q点平衡常数K的大小关系为K(M)=K(Q) >K(N) |
| B.加催化剂能加快反应速率但H2的平衡转化率不变 |
| C.相同压强下,投料相同,达到平衡消耗时间关系为c>b>a |
| D.由曲线a可知,当压强增加到100 MPa以上,NH3的物质的量分数可达到100% |
③N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K=_________________(精确到小数点后两位)。
(3)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为______________________。
(4)NH3可以处理NO2的污染,方程式如下: NO2+ NH3 N2+ H2O(未配平)当转移0.6 mol电子时,消耗的NO2在标准状况下是 L。
N2+ H2O(未配平)当转移0.6 mol电子时,消耗的NO2在标准状况下是 L。
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
于是提出猜想,NO2和碱性的NaHCO3溶液也能发生类似反应。该小组利用如图所示装置,使NO2和NaHCO3溶液充分反应后,获得溶液X。

(1)Cu与浓硝酸反应的现象是_______________________。
(2)该小组同学为了对猜想进行探究,进行如下讨论和实验。
①甲同学认为,可通过检验X中是否存在NO3—的方法验证猜想。但经讨论后认为不可行,你认为其原因是 。
②乙同学在X中加入少量K2Cr2O7溶液,结果溶液褪色,则证明X中含有NaNO2。根据以上信息,写出NO2与NaHCO3溶液反应的离子方程式_________________ 。
(3)已知在酸性条件下NO2— 能将I— 氧化为I2。你认为能否用KI淀粉溶液检验X中存在NaNO2: ___________(填“能”或“不能”),原因是____________________________。
(4)已知5NO2— + 2MnO4—+6H+= 5NO3—+ 2Mn2+ +3H2O。称取a g KMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250 mL溶液。移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定,消耗b mL KMnO4溶液。滴点终点的现象是 ,则X中NaNO2的浓度是______________(用含a、b的式子表示)。
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物:CmHn(烃)、SO2、NOx、CO和C等,请回答下列有关问题:
(1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为________________,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由________能转化为________能,最终转化为机械能;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中的__________(填化学式,多填本空不得分)排放;
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式________。
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
NaClO过量时,易发生N2H4•H2O+2NaClO═N2↑+2NaCl+3H2O
实验一:制备NaClO溶液.(实验装置如图1所示)
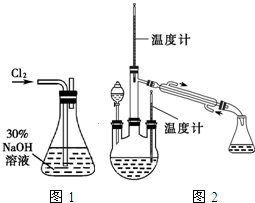
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有______________(填标号);
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应的化学方程式是______________;
实验二:制取水合肼.(实验装置如图2所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(已知:N2H4•H2O+2NaClO═N2↑+3H2O+2NaCl)
(3)分液漏斗中的溶液是_______(填标号);
A.CO(NH2)2溶液
B.NaOH和NaClO混合溶液
选择的理由是______________;
实验三:测定馏分中肼含量
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol•L-1的I2溶液滴定.滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4•H2O+2I2═N2↑+4HI+H2O)
(4)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,用离子方程式解释其原因______________;
(5)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4•H2O)的质量分数为___________;
下列装置用于实验室制氨气或验证氨气的某化学性质,其中能达到实验目的的是
| A.用装置甲制取氨气 |
| B.用装置乙除去氨气中的水蒸气 |
| C.用装置丙验证氨气具有还原性 |
| D.用装置丁吸收尾气 |
自然界中氮元素有多种存在形式。
(1)合成氨反应的化学方程式是_________________。
(2)NH3在一定条件下可被氧化.
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol
ⅱ.
①断开1mol H-O 键与断开 1mol H-N 键所需能量相差约_________kJ;
(3)下图是某压强下,N2与H2按体积比1:3投料时,反应混合物中氨的体积分数随温度的变化曲线.其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线.
②H-O 键比H-N键(填“强”或“弱”)_____;
①图中b点,v(正)_____v(逆).(填“>”、“=”或“<”)
②图中a点,容器内气体n(N2):n(NH3)=_____。
(4)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是_______________。
(5)电解法能将碱性溶液中的NO2-转化为N2而除去,其电极反应式是_______________。