1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法中不正确的是( )
| A.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.该合金中铜与镁的物质的量之比是2:1 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
一定是的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
| A.13.5L | B.9.0L | C.16.8L | D.15.7L |
莫尔盐[(NH4)2Fe(SO4)2·8H2O]溶液经常用于定量滴定实验。下列有关说法正确的是
| A.配制0.1mol•L-1莫尔盐溶液500mL,需莫尔盐19.6克 |
| B.可与含Fe2+、HClO、H+、Cl-微粒的溶液大量共存 |
| C.加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)2↓ |
| D.取样,加入浓NaOH溶液并加热,出现可让蓝色石蕊试纸变红的气体,证明含NH4+ |
某同学用下列实验装置探究硝酸的性质。根据图示判断下列结论不正确的是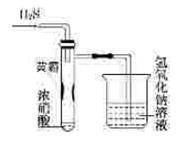
| A.试管内壁上“黄霜”的成分是硫 |
| B.该实验探究说明浓硝酸既有氧化性,又有挥发性 |
| C.烧杯内的NaOH溶液的作用是除去尾气,防止尾气污染环境 |
| D.H2S用SO2代替,将无明显反应现象 |
下列物质的转化均能通过一步反应实现的是
| A.NaAlO2 A1(OH)3 A1 | B.N2 NO2 HNO3 |
| C.NaOH Na2CO3 NaHCO3 | D.FeS2 S03 H2SO4 |
某硫酸和硝酸的混合溶液20 mL,其中含有硫酸的浓度为2 mol·L-1,含有硝酸的浓度为1 mol·L-1,现向其中加入0.96 g 铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为 ( )
| A.224 mL | B.168 mL | C.112 mL | D.448 mL |
关于氮的变化关系图如下:

则下列说法不正确的是( )
| A.路线①②③是工业生产硝酸的主要途径 |
| B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径 |
| C.上述所有反应都是氧化还原反应 |
| D.上述反应中只有③属于氮的固定 |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+ 恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60mL | B.45mL | C.30mL | D.15mL. |
工业废气中的氮氧化物是主要污染源,为了治理污染,常通入 ,发生
,发生 反应来治理污染.现有NO、
反应来治理污染.现有NO、 混合气体3L,用同温同压下3.5L
混合气体3L,用同温同压下3.5L 使其恰好完全转化为
使其恰好完全转化为 ,则混合气体中NO、
,则混合气体中NO、 的物质的量之比为( )
的物质的量之比为( )
| A.1∶1 | B.2∶1 | C.1∶3 | D.1∶4 |
利用下图M、N两个装置进行相关实验,下列有关说法正确的是

| 选项 |
所用装置 |
描述 |
结论 |
| A |
M |
W:BaCl2 ;X:CO2 Y:SO2 |
M中有白色沉淀生成 |
| B |
M |
W:饱和食盐水;先通入X:CO2,再通入Y:NH3 |
M中制得小苏打 |
| C |
N |
X:NH3 Y:Cl2 |
Z出口有白烟产生 |
| D |
N |
X:NH3 Y:O2 |
Z出口有红棕色气体 |
某稀硫酸和稀硝酸的混合溶液200ml,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解m g。向另一份中逐渐加入铁粉,产生的气体量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)下列分析或结果错误的是 ( )

| A.第二份溶液中最终溶质为FeSO4 |
| B.原混合酸中NO3-物质的量为0.1mol |
| C.m值为9.6 |
| D.H2SO4浓度为2.5mol/L |
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是 ( )
| A.0.3mol NO、0.1mol NO2 | B.0.3mol NO2 |
| C.0.6mol NO | D.0.3mol NO2、0.1mol NO |
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加人3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。则下列叙述中不正确的是( )
| A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL |
| B.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
| C.参加反应的金属的总质量为9.6 g>m>3.6 g |
| D.当金属全部溶解时收集到NO气体的体积一定为2.24 L。 |
将容积为50mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5mL。则原混合气体中NO2和O2体积比可能是( )
| A.9:1 | B.18:7 | C.41:9 | D.1:1 |