下列有关化学用语表达正确的是
A.碳酸氢根离子的水解方程式:HCO3-+H2O H3O++CO32- H3O++CO32- |
B.聚丙烯的结构简式: |
C.钾原子的结构示意图: |
D.甲烷分子的比例模型: |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA |
| B.78 g苯含有C=C键的数目为3 NA |
| C.常温常压下,14 g由N2和CO组成的混合气体含有的电子总数为7 NA |
| D.1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
下列说法中正确的是( )
| A.25℃时,NH4Cl和NH3 .H2O的混合液中离子浓度可能为c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B.向0.1mol/L的CuSO4溶液中加入少量蒸馏水,溶液酸性减弱,Cu2+水解程度降低 |
| C.25℃时,PH=12的NaOH溶液、PH=12的CH3COONa溶液、PH=2的硫酸,三种溶液中水的电离程度相同 |
| D.25℃时,向稀氨水中通入NH3,溶液中c(OH-)减小 |
下列关于电解质溶液的叙述正确的是( )
A.常温下,由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH B++OH- B++OH- |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
下列方程式书写正确的是( )
| A.HCO3﹣在水溶液中的电离方程式:HCO3﹣+H2O⇌H3O++CO32﹣ |
| B.H2SO3的电离方程式:H2SO3⇌2H++SO32﹣ |
| C.CO32﹣的水解方程式:CO32﹣+2H2O⇌H2CO3+2OH﹣ |
| D.NaHCO3的电离方程式:NaHCO3═Na++H++CO32﹣ |
25 ℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )
| A.a=b | B.a>b | C.c(A-)=c(Na+) | D.c(A-)<c(Na+) |
常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
下列离子方程式正确的是
A.碳酸氢钠水解:HCO3-+ H2O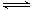 H3O++ CO32- H3O++ CO32- |
B.醋酸铵溶于水:CH3COONH4+ H2O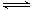 CH3COOH + NH3·H2O CH3COOH + NH3·H2O |
| C.硫酸钙悬浊液中加入碳酸钠:CaSO4(s) + CO32-(aq)=CaCO3(s) + SO42-(aq) |
| D.硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:HSO4-+ OH-=SO42-+ H2O |
下列过程或现象与盐类水解无关的是
| A.纯碱溶液去油污 |
| B.铁在潮湿的环境下生锈 |
| C.加热氯化铁溶液颜色变深 |
| D.浓硫化钠溶液有臭鸡蛋味 |
下列说法正确的是
| A.实验中需用0.20 mol·L-1的NaOH溶液950mL,配制时应称取NaOH的质量8.0g |
| B.升高NH4Cl溶液温度,其水的离子积常数和pH均增大 |
| C.水比硫化氢稳定的原因是水分子间存在氢键 |
| D.在pH等于2的醋酸溶液中加入少量0.01 mol·L-1的稀盐酸,溶液的pH会变小 |
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 |
现象或事实 |
解释 |
| A |
用热的纯碱溶液洗去油污 |
Na2CO3可直接和油污反应 |
| B |
漂白粉在空气中久置变质 |
漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
| C |
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 |
K2CO3与NH4Cl反应生成氨气会降低肥效 |
| D |
FeCl3溶液可用于铜质印刷线路板制作 |
FeCl3能从含有Cu2+的溶液中置换出铜 |
物质的量浓度相同的下列溶液,NH4+浓度最大的是( )
| A.NH4Cl | B.NH4HSO4 | C.CH3COO NH4 | D.NH4HCO3 |
下列说法正确的是
| A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 |
| B.在任何含AgCl固体的溶液中都存在c(Ag+) = c(Cl-) |
| C.温度一定,当溶液中存在c(Ag+),c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入盐酸,其Ksp值变大 |
下列溶液中微粒的物质的量浓度关系正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液:c(H+)= c(OH-)= c(NH )=c(Cl-) )=c(Cl-) |
| B.0.1 mol/L Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| D.常温下,pH=2的CH3COOH与pH=12的NaOH等体积混合:c (CH3COO-)+ c(H+)>c(Na+)+c(OH-) |