下列电离或水解方程式正确的是
A.Na2SO3的水解:SO32-+ 2H2O H2SO3 + 2OH- H2SO3 + 2OH- |
B.NaHCO3的电离:NaHCO3  Na + + H+ + CO32- Na + + H+ + CO32- |
C.KHS溶液中HS-的电离:HS-+ H2O  H3O+ + S2- H3O+ + S2- |
| D.NaClO溶液与FeCl2溶液混合:2ClO- + Fe2+ + 2H2O =" 2HClO" + Fe(OH)2↓ |
对于0.1 mol·L-1 NH4Cl溶液,下列说法或列式正确的是
| A.升高温度,溶液pH升高 |
| B.c(NH4+) + c(OH-)=c(Cl-)+ c(H+) |
| C.通入少量HCl,c(NH4+)和c(Cl-)均增大 |
| D.c(Cl-) > c(H+) > c(NH4+) > c(OH-) |
下列方程式的表达正确的是
A.甲烷与氯气在光照下反应: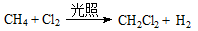 |
| B.次氯酸在水中发生电离:HClO + H2O = H3O+ + ClO- |
C.碳酸钠在水中发生水解:CO32- + 2H2O H2CO3 + 2OH- H2CO3 + 2OH- |
D.氯化铵在水中发生水解:NH4++ 2H2O NH3.H2O + H3O+ NH3.H2O + H3O+ |
下列水解的离子方程式正确的是( )
A.NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
B.Br-+H2O HBr+OH- HBr+OH- |
C.CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
D.Fe3++3H2O Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
在55 ℃时,下列说法正确的是
| A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 |
| B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L |
| C.饱和氯水中: c(Cl-)=c(ClO-)+c(HClO) |
| D.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+) >c(H+)>c(OH-) |
下列反应所得溶液中一定只含一种溶质的是
| A.向NaOH溶液中通入CO2 |
| B.向Ca(OH)2溶液中通入Cl2 |
| C.向蒸馏水中加入少量金属Na |
| D.向MgSO4溶液中滴入NaOH溶液 |
下列说法中正确的是
A.8NH3(g)+6NO2(g) 7N2(g)+12H2O(g) ΔH<0,则该反应一定能自发进行 7N2(g)+12H2O(g) ΔH<0,则该反应一定能自发进行 |
| B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
| C.催化剂可以加快化学反应速率,也能增大化学反应的焓变 |
| D.NH3·H2O溶液加水稀释后,溶液中的值增大 |
化学与生活息息相关.下列说法不正确的是
| A.可用淀粉﹣KI试纸和食醋检验真假碘盐 |
| B.用饱和氯化铵溶液可以清洗金属表面的锈迹 |
| C.次氯酸钠溶液是生活中常用的消毒剂 |
| D.经常食用含明矾的食品能中和过多的胃酸 |
证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是( )
| A.加入盐酸 |
| B.加入Ba(OH)2溶液 |
| C.测定溶液的pH值 |
| D.加入品红溶液 |
下列现象不能用盐类水解知识解释的是
| A.明矾能用于净水 |
| B.泡沫灭火器的原理 |
| C.铜绿的生成 |
| D.配置FeCl2溶液时加入少量的盐酸 |