下列说法正确的是
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(Cl-)>c(NH4+) |
| C.0.1 mol·L-1的氯化铵溶液与0.05 mol·L-1的氢氧化钠溶液等体积混合,溶液中离子浓度c(Cl-)>c(NH4+)>c(Na+)>c(OH-) |
| D.0.1 mol·L-1硫化钠溶液中离子浓度关系c(OH-)=c(H+)+c(HS-)+2c(H2S) |
下列事实不属于盐类水解应用的是( )
| A.明矾、氯化铁晶体常用于净水 | B.实验室制氢气时加CuSO4可加快反应速率 |
| C.实验室配制FeCl3溶液时加入少量稀盐酸 | D.实验室通常使用热的纯碱溶液去除油污 |
下列水解离子方程式正确的是:
A.CO32-+H2O CO2 +2OH- CO2 +2OH- |
B.I-+H2O HI+OH- HI+OH- |
C.SO32-+2H2O H2SO3+2OH- H2SO3+2OH- |
D.HPO42- +H2O H2PO4- +OH- H2PO4- +OH- |
将标准状况下的2.24LCO2通入150m1 1mol/LNaOH溶液中,下列说法正确的是( )
| A.c(HCO3-)略大于c(CO32-) | B.c(HCO3-)等于c(CO32-) |
| C.c(Na+)等于c(CO32-)与c(HCO3-)之和 | D.c(HCO3-)略小于c(CO32-) |
25℃时,在浓度均为1 mol∙L−1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其c(NH4+)分别为a、b、c(单位为mol∙L−1)。下列判断正确的是( )
| A.a=b=c | B.a>b>c | C.a>c>b | D.c>a>b |
下列物质的水溶液因发生水解而显酸性的是
| A.NaHSO4 | B.KCl | C.NH4Cl | D.H2SO4 |
25 ℃时,水的电离达到平衡:H2O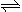 H++OH- ΔH>0,下列叙述正确的是( )
H++OH- ΔH>0,下列叙述正确的是( )
| A.向水中加入稀氨水,平衡逆向移动,[OH-]降低 |
| B.向水中加入少量固体硫酸氢钠,[H+]增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,[H+]降低 |
| D.将水加热,Kw增大,pH不变 |
在配置Fe2(SO4)3溶液时,为了防止水解,常常往溶液中加入少量的( )
| A.NaOH | B.H2SO4 | C.KCl | D.CH3COOH |
下列离子方程式中,属于水解反应的是 ( )
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO+H2O HCO+OH- HCO+OH- |
C.CO2+H2O HCO+H+ HCO+H+ |
D.HS-+H2O .S2-+H3O+ .S2-+H3O+ |
常温下,把盐酸和氨水等体积混合后,其溶液的pH恰好等于7,则下列说法中正确的是( )
| A.盐酸中的c(H+)一定小于氨水中的c(OH-) |
| B.盐酸的物质的量浓度一定小于氨水的物质的量浓度 |
| C.反应后生成的盐溶液一定没有发生水解 |
| D.盐酸中HCl的物质的量一定等于NH3・H2O的物质的量 |
下列过程或现象与盐类水解无关的是
| A.纯碱溶液去油污 |
| B.加热稀醋酸溶液其pH 稍有减小 |
| C.配置FeCl3溶液时,加入少量HCl,以防止溶液浑浊 |
| D.水中加入明矾可以净化水 |