下列水解的离子方程式正确的是
A.S2﹣+2H2O H2S+2OH﹣ H2S+2OH﹣ |
B.Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+ |
C.HCO3﹣+H2O CO32﹣+H3O+ CO32﹣+H3O+ |
D.HS﹣+H2O H2S↑+OH﹣ H2S↑+OH﹣ |
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
25℃ 时,水的离子积为Kw,该温度下将 a mol ·L-盐酸 与b mol·L-1氨水等体积混合,若恰好完全反应,下列结论中不正确的是
A.混合液中:c(H+ ) ≤ |
| B.混合液中:c(NH3·H2O)+c(NH4+)=0.5a mol·L-1 |
| C.a = b |
| D.混合液中:c(H+)+c(NH4+)= c(OH-)+c(Cl-) |
下列各组离子中,因相互促进水解,而不能大量共存的是
| A.Al3+、SO42-、CO32-、Cl- |
| B.Na+、HCO3-、AlO2-、Cl- |
| C.H+、HS-、Na+、SO32- |
| D.OH-、Na+、K+、HCO3- |
下列说法正确的是
| A.酸式盐的水溶液一定显碱性 |
| B.醋酸铵溶液呈中性是因为溶液中H+的物质的量和OH-的物质的量相等 |
| C.NaHSO3溶液的PH大于Na2SO4溶液的PH |
| D.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性 |
室温下0.1mol/L的NH4CN溶液的pH等于9.32。下列说法错误的是
| A.上述溶液能使甲基橙试剂变黄色,石蕊试液变蓝 |
| B.室温下,HCN是比NH3·H2O更弱的电解质 |
| C.上述溶液中NH4+的水解程度大于CN-的水解程度 |
| D.室温下,0.1mol/LNaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度 |
温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是
| A.③①④②⑤ | B.①③⑤④② |
| C.③②①⑤④ | D.⑤②④①③ |
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
下列离子方程式中,属于水解反应的是
A.CH3COOH+H2O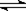 CH3COO-+H3O+ CH3COO-+H3O+ |
B.CO2+H2O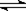 HCO3- +H+ HCO3- +H+ |
C.CO32-+H2O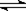 HCO3-+OH- HCO3-+OH- |
D.HS-+H2O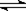 S2-+H3O+ S2-+H3O+ |
下列说法正确的是v( )
| A.盐溶液都是中性的 |
| B.盐溶液的酸碱性与盐的类型无关 |
| C.NaHCO3溶液显酸性 |
| D.碳酸钠溶液显碱性,溶液中c(OH-)>c(H+) |
在NH4Cl与NH3·H2O组成的混合液中,下列关系一定正确的是
| A.c(NH4+)>c(Cl—) | B.c(H+)=c(OH—) |
| C.c(NH4+)+c(NH3·H2O)>c(Cl—) | D.c(NH4+)>c(Cl—)+c(OH—) |