常温下,下列有关醋酸溶液的叙述中不正确的是
| A.pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| B.浓度为0.2mol/L的CH3COOH溶液和浓度为0.1mol/L的NaOH溶液等体积混合后: c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
C.醋酸浓溶液加少量水稀释,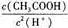 几乎不变 几乎不变 |
| D.amol/LCH3COOH溶液与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CH3COO-),则一定有a≤b |
25℃时,Kw=1.0×10﹣14;100℃时,Kw=5.5×10﹣13.下列说法正确的是( )
| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 |
| C.25℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
下列说法正确的是( )
| A.泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里。 |
B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14 |
| D.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
下列两种溶液混合后,所得溶液中各离子浓度关系不正确的是( )
| A.0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
| D.0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
常温下,VL pH=2的盐酸与0.2L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是( )
| A.V一定等于0.2 |
| B.V大于或等于0.2,也有可能小于0.2 |
| C.混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)> c(H+)>c(OH-) |
| D.混合溶液中离子浓度可能满足:c(Cl-)> c(H+)> c(NH4+) >c(OH-) |
保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,一段时间后下列叙述正确的是( )
| A.Na2CO3溶液的碱性增强 |
| B.阳极反应:CO32--2e-+H2O = CO2↑+2OH- |
C.溶液中CO32-+H2O  HCO3-+OH-平衡不移动 HCO3-+OH-平衡不移动 |
| D.向溶液中加入一定量HCOOH的能复原 |
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3  H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式____________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中
c (H+) = 2.5×10-2 mol·L-1,除OH-之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中
c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
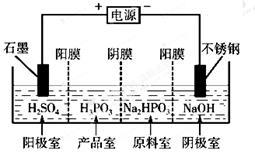
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为________________________。
②产品室中反应的离子方程式为________________。
化学中常用图象直观地描述化学反应的进程或结果。下列图象描述正确的是
A.根据图①可判断可逆反应A2(g)+3B2(g) 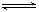 2AB3(g),正反应是吸热反应 2AB3(g),正反应是吸热反应 |
B.图②表示压强对可逆反应2A(g)+2B(g)  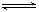 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
D.根据图④溶解与溶液pH的关系,若除去 溶液中的Fe3+可向溶液中加入适量 CuO,至pH在4左右 溶液中的Fe3+可向溶液中加入适量 CuO,至pH在4左右 |
下列溶液中,微粒浓度关系正确的是
A.含有 的溶液中,其离子浓度一定是: 的溶液中,其离子浓度一定是: >c(OH-) >c(OH-) |
B.pH=6的醋酸与醋酸钠的混合溶液中, |
C.0.1 mol/L的Na2S溶液中, |
D.pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是 |
(Ⅰ)A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题。

(1)已知常温下A为有色气体。若F是一种金属单质,写出B和适量F反应生成C与气体E的离子方程式_______________________;
(2)若A为双原子分子,C为直线型分子,E具有漂白性,物质F焰色反应呈黄色.则F的化学式为_____________________。
(3)若A为淡黄色固体,则A与水反应的化学方程式为_________________。
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题即_______________。C与F反应的化学方程式为________________;
②若物质A和D的式量相等,D为白色絮状沉淀,写出C与F反应的离子方程式_________________________。
(Ⅱ)亚磷酸(H3PO3)是二元弱酸,与足量NaOH溶液反应,生成Na2HPO3。
(1)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”)。常温下,向10mL0.01 mol·L-1H3PO3溶液中滴加10mL0.02 mol·L-1NaOH溶液后,溶液中各种离子浓度由大到小的顺序是_________ ;
(2)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的方程式为______.
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:
i.Fe3+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;
[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色) + nH2O  [Fe(H2O)6-n(OH)n]3-n(黄色) + nH3O+(n = 0~6) ;
[Fe(H2O)6-n(OH)n]3-n(黄色) + nH3O+(n = 0~6) ;
ii.[FeCl4(H2O)2]-为黄色。
进行实验:
【实验I】

【实验II】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。

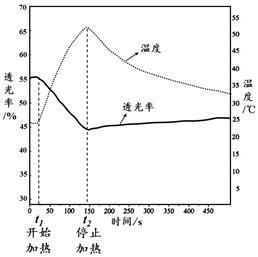
图1 图2
Fe(NO3)3溶液透光率随温度变化曲线 FeCl3溶液透光率随温度变化曲线
(1)实验I中,试管②溶液变为无色的原因是 。
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是 。
(3)由实验II图1、2可知:加热时,溶液颜色 (填“变浅”、“变深”或“不变”)。
(4)由实验II,可以得出如下结论:
[结论一] FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]- + 4H2O 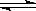 [Fe(H2O)6]3+ + 4Cl-,得出此结论的理由是 。
[Fe(H2O)6]3+ + 4Cl-,得出此结论的理由是 。
[结论二] 结论一中反应的ΔH (填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液, (请描述必要的实验操作和现象)。
常温下,下列溶液中微粒的物质的量浓度关系正确的是
| A.将等体积、等物质的量浓度的CH3COONH4与CH3COONa溶液混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) |
| B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3·H2O) |
| C.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) |
| D.向0.10mol·L-1 Na2CO3溶液中通入少量CO2的溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
常温下,下列有关叙述正确的是( )
| A.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-6mol•L-1 |
| B.pH相等的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ |
| C.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |