25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的精确计算结果(填具体数字):c (Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、=);
(5)将相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列 (填序号)
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
| C.0. 1 mol·L-1Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是 (填序号)。
(2)若溶液中只有一种溶质,则该溶质为 ,该溶液中离子浓度的大小关系为 (填序号)。
(3)若关系③正确,则溶液中溶质为 。
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va Vb(填>、<、=、无法确定)。
常温下,下列溶液中各离子浓度关系正确的是
| A.浓度为0.1 mol·L-1的碳酸钠溶液:c(Na+)=2c(CO32—)+c(HCO3—) +c(H2CO3) |
| B.pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl—)>c(NH4+)>c(H+)>c(OH—) |
| C.等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) |
| D.醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO—) |
常温下,向20mL 0.10mol·L-1 NaHCO3溶液中滴加0.10mol·L-1 CaCl2溶液至pH=7,有白色沉淀生成,无气体放出。对反应所得混合液的下列说法错误的是
| A.存在电离平衡、水解平衡和沉淀溶解平衡 |
| B.c(Na+)=c(Cl-)>c(HCO3-)>c(CO32-)=c(Ca2+) |
| C.c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-) |
| D.反应的离子方程式:2 HCO3-+Ca2+==CaCO3↓+H2CO3 |
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)  TaI4(g)+S2(g) ΔH>0 (Ⅰ)
TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2的晶体,则温度T1______T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为______________,滴定反应的离子方程式为___________________。
(4)25 ℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=________,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=________,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
中学化学实验,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在如下平衡H2O  H++OH- ΔH>0。现欲使平衡向右移动,且所得溶液呈中性,选择的方法是 (填字母)。
H++OH- ΔH>0。现欲使平衡向右移动,且所得溶液呈中性,选择的方法是 (填字母)。
| A.向水中加入NaHSO4溶液 |
| B.向水中加入Cu(OH)2固体 |
| C.加热水至100 ℃[其中c(H+)="1×10-6" mol·L-1] |
| D.在水中加入H2SO4溶液 |
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,若用pH计测定,则pH 7(填“>”“<”或“=”),溶液呈 性(填“酸”“碱”或“中”)。
(3)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且 3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后: c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12, |
则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
25℃时,浓度均为0.1mol·L-1的HA溶液和BOH溶液,pH分别是1和12。下列说法正确的是( )
| A.在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) |
| B.若将0.1mol·L-1BOH溶液稀释至0.001 mol·L-1则溶液的pH=10 |
| C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) |
| D.若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是( )
| A.c( NH4+ )>c(Cl-)>c(OH-)>c(H+) |
| B.c( NH4+)>c(OH-)>c(Cl-)>c(H+) |
| C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.c( NH4+)>c(H+)>c(Cl-) >c(OH-) |
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
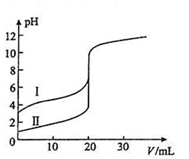
| A.Ⅰ表示的是滴定盐酸的曲线 |
| B.PH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| C.V(NaOH) =20ml时,C(Cl— )="=" C(CH3COO— ) |
| D.V(NaOH) =10ml时,醋酸溶液中:C(Na+ )> C(CH3COO— )> C(H+ )> C(OH— ) |
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
| |
Ka1 |
Ka2 |
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 |
HX |
HY |
HZ |
||
| 浓度(mol/L) |
0.12 |
0.2 |
0.9 |
1 |
1 |
| 电离度 |
0.25 |
0.2 |
0.1 |
0.3 |
0.5 |
| 电离常数 |
Ki1 |
Ki2 |
Ki3 |
Ki4 |
Ki5 |
已知:
A.在相同温度下,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且Ki1>Ki2>Ki3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合溶液:c(X-)+c(Y-)—2c(Z-)=2c(HZ)—c(HX)—c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,Ki5>Ki4>Ki3
某化学兴趣小组做了Na2CO3的相关性质实验,请按要求回答问题:
第一步:称量10.6g Na2CO3固体全部溶于水中,配成100mL溶液;
第二步:量取5.0mL上述溶液于试管中,再滴加2滴酚酞溶液,观察到的现象是 ,请说明原因 (用离子方程式表示);
第三步:将第二步试管中的溶液均分成2份,一份微微加热,观察到的现象是 ,请说明原因: (用文字说明);另一份慢慢滴加1.0 mol/L CaCl2溶液,观察到的现象是 ;
第四步:再量取4mL Na2CO3溶液于干净的试管中,缓慢滴加1.0mol/L HCl溶液2mL,滴加过程中始终没有观察到气泡产生,请说明原因 (用离子方程式表示)。
80°C,0.1 mol/L NaHB溶液中c(H+)>c(OH–),可能正确的关系是
A.c(Na+)+ c(H+)= c(HB–)+ 2c(B2–) B.溶液的pH=1
C.c(H+)∙c(OH–)= 10–14 D.c(Na+)= c(H2B)+ c(HB–)