室温时,盐酸和硫酸的混合溶液20 mL,向混合物中逐滴加入0.05mol/LBa(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。
下列说法正确的是
| A.图中A点对应溶液的pH:a=1 |
| B.生成沉淀的最大质量m=2.33g |
| C.原混合液中盐酸物质的量浓度为0.1mol/L |
| D.当V[Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2+ + SO42-=BaSO4↓ |
MOH强碱溶液和等体积等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
| A.c(M+)>c(OH-)>c(A-)>c(H+) | B.c(M+)> c(A-) > c(H+)> c(OH-) |
| C.c(M+)> c(A-) > c(OH-) >c(H+) | D.c(M+)> c(H+) >c(A-)> c(OH-) |
已知两种溶液:①0.lmol/LH2SO4溶液 ②0.2mol/LCH3COONa溶液。下列有关说法中,正确的是
| A.相同温度下,溶液中水的电离程度:溶液①>溶液② |
B.加热②,溶液中 不变 不变 |
| C.等体积混合溶液①和②,所得溶液中c(CH3COO-)+2c(SO42-)=c(Na+) |
| D.25℃时,向溶液①中滴加溶液②至pH=7,溶液中c(Na+)>c(SO42-) |
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l) △H=−67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l) △H=−57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
| A.氢氟酸的电离方程式及热效应可表示为:HF(aq)=H+(aq) +F−(aq)△H=+10.4KJ·mol—1 |
| B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+) |
| C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1 |
| D.当V>20时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+) |
25℃时,pH=3的盐酸aL分别与下列3种溶液充分混合后,溶液均呈中性:
①c(NH3·H2O)=10-3mol·L-1的氨水bL;
②c(OH-)=10-3mol·L-1的氨水cL;
③c(OH-)=10-3mol·L-1的Ba(OH)2溶液d L。
试判断a、b、c、d的数量大小关系为
| A.a=b>c>d | B.b>a=d>c |
| C.b>a>d>c | D.c>a=d>b |
25℃时,若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A.生成了一种强酸弱碱盐 | B.弱酸溶液和强碱溶液反应 |
| C.强酸溶液和弱碱溶液反应 | D.一元强酸溶液和一元强碱溶液反应 |
常温下,用0.1 mol/L的NaOH溶液滴定10.0 mL0.1 mol/L的HA溶液,其滴定曲线如图所示,下列说法不正确的是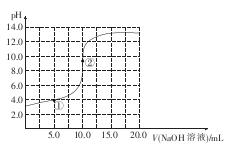
A.HA是弱酸
B.②处:c(H+)>c(OH-)
C.①处:c(Na+)<c(A-)
D.②处:c(Na+)=c(A-)+c(HA)
常温下下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+ |
| B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+ |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+ |
| D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN- |
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
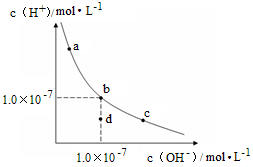
| A.升高温度,可能引起由c向b的变化 |
| B.该温度下,水的离子积常数为1.0×10-13 |
| C.该温度下,加入FeCl3可能引起由b向a的变化 |
| D.该温度下,稀释溶液可能引起由c向d的变化 |
常温下,下列各组离子在相应的条件下可能大量共存的是
| A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ |
B.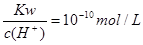 的溶液中:Na+、HCO3-、Cl-、K+ 的溶液中:Na+、HCO3-、Cl-、K+ |
| C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- |
| D.由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42- |
用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是( )
| A.试样中加入酚酞作指示剂,用标准酸液进行滴定 |
| B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定 |
| C.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行测定 |
| D.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定 |
40℃时,在氨-水体系中不断通入CO2,各种离子变化趋势如下图所示。下列说法不正确的是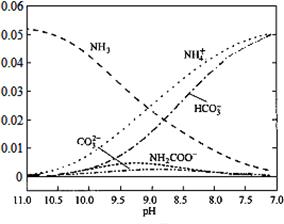
| A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) |
| B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
C.随着CO2的通入,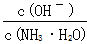 不断增大 不断增大 |
| D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )

| A.a点由水电离出的c(H+)=1.0×10-14mol•L-1 |
| B.b点:c(NH4+)+c(NH3•H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,容易温度略下降的主要原因是NH3•H2O电离吸热 |
下列有关说法不正确的是
A.将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
B.上图可表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
C.25℃时,pH=2的1.0 L 醋酸溶液中水电离出的H+的数目为10-12NA
D.某吸热反应能自发进行,则该反应一定是熵增的反应