常温下,下列有关水的电离平衡:H2O H++OH- DH>0 ,叙述正确的是
H++OH- DH>0 ,叙述正确的是
| A.向水中加入少量固体碳酸氢钠,平衡向右移动,KW不变,c(OH-)增大 |
| B.向水中加入稀氨水,平衡向左移动,c(OH-)降低 |
| C.向水中加入少量金属Na,平衡向左移动,c(OH-)降低 |
| D.将水加热,平衡向右移动,KW增大,pH增大 |
25 ℃时,水的电离达到平衡:H2O  H+ + OH- ΔH > 0 ,下列叙述正确的是( )
H+ + OH- ΔH > 0 ,下列叙述正确的是( )
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数不变 |
| C.向水中加人少量固体NaOH ,平衡正向移动,c(H+)降低 |
| D.将水加热,水的离子积常数增大,pH不变 |
是最宝贵的资源之一。下列表述正确的是
A.H2O的电子式为 |
| B.4℃时,纯水的pH=7 |
| C.D216O中,质量数之和是质子数之和的两倍 |
D.273K、101kPa,水分之间的平均距离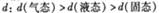 |
室温下,向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,下列示意图变化趋势正确的是( ) 
将物质的量浓度为X mol/L的稀盐酸与物质的量浓度为Y mol/L的稀NaOH溶液等体积混合,所得溶液的pH=2(混合后体积不变),则X和Y的关系是
| A.X=Y+0.01 | B.X=2Y | C.Y=2X | D.X=Y+0.02 |
向等体积pH均为1的盐酸和醋酸溶液中分别滴加等物质的量浓度的氢氧化钠溶液,当最后得到的两溶液pH相等时,盐酸中用去氢氧化钠溶液的体积为Vl,醋酸中用去氢氧化钠溶液的体积为V2。则Vl和V2的关系正确的是
| A.Vl==V2 | B.Vl>V2 | C.Vl<V2 | D.Vl≤V2 |
25℃某一元强酸的体积为Va、pH=a,和体积为Vb、pH=b为的一元强碱混合后的pH为7,已知Va<Vb,且a=0.5b,则b的取值范围是 ( )
| A.7/2<b<14/3 | B.7<b<28/3 | C.8<b<13 | D.9 <b<12 |
25℃时,对下列各溶液叙述中正确的是
| A.pH=2的盐酸与pH=l的硫酸溶液中c(H+)之比为2 :1 |
| B.4种pH相同的溶液:①CH3COONa②C6H5ONa③NaHCO3④NaOH,各溶液的物质的量浓度由大到小的顺序是③>②>①>④ |
| C.0.1 mol/LHA(某酸)pH=3,0.1 mol/L BOH(某碱)pH=13,则BA(盐)的溶液pH<7 |
| D.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,c(Na)>c(CH3COO)>c(H)>c(OH) 2010届郑州高中毕业班第三次质量预测理综化学部分 |
常温时,下列溶液的pH等于8或大于8的是
| A.0.1 mol·L-1的NaOH溶液滴定稀盐酸,用酚酞做指示剂滴定到终点 |
| B.pH=6的醋酸用水稀释100倍 |
| C.pH=10的氢氧化钠溶液稀释1000倍 |
| D.0.1 mol·L-1的硫酸100 mL跟0.2 mol·L-1 NaOH溶液150 mL完全反应 |
下列说法正确的是
| A.常温下若强酸、强碱等体积中和后pH=7,则中和之前pH酸+pH碱=14 |
| B.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH |
| C.测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
| D.在pH=12的溶液中,水电离出的c(OH-)=10-2mol·L-1 |
常温下,取pH="2" 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)="0.01mol" /L
C.pH=3的NaHA水溶液中,离子浓度大小为
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为
c(Na+)>c(B2-)>c(OH-)>c(H+)
用0.10mol/L的NaOH溶液滴定100.0mL0.10mol/LHCl溶液时,滴定误差在±0.1%以内,反应完毕后溶液的pH变化范围是
| A.6.9~7.1 | B.4.3~9.7 | C.3.6~10.4 | D.以上都不正确 |
常温下,pH=11的NaOH溶液aL分别与下列3种溶液混合,充分反应后使溶液呈中性:
①pH=3的醋酸bL;②物质的量浓度为1×10-3 mol/L的醋酸c L;③ c(OH-)=1×10-11 mol/L的H2SO4的溶液d L。判断a、b、c、d的大小关系,正确的是
|
室温下,VaLpH=a的强酸与VbLpH=b的强碱溶液混合,混合后溶液pH=3。已知a+b=13,Vb=4.5Va ,则a值为
| A.2 | B.3 | C.4 | D.5 |