常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.0.1mol·L-1NaHCO3溶液中的粒子浓度:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.将标况下2.24L的CO2通入150mL 1mol·L-1NaOH溶液中充分反应后的溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+2c(A-)=c(H+)+2c(HA)
(1)某学生用标准盐酸滴定待测的NaOH溶液,根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.100 0 mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
则依据表中数据,该NaOH溶液的物质的量浓度为 。
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度。用甲基橙作指示剂,下列操作可能使测定结果偏低的是__________。
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00 mL酸性高锰酸钾溶液应用 。(填仪器名称)
(4)莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 |
AgCl |
AgBr |
Ag2CrO4 |
| 颜色 |
白 |
浅黄 |
砖红 |
滴定终点的现象是 。终点现象对应的离子反应方程式为 。
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0 g,置于锥形瓶中,加50 mL水,再加入2 g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10 min,然后加150 mL蒸馏水并加入3 mL 0.5%淀粉溶液,用0.100 0 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00 mL,则上述产品中(NH4)2Cr2O7的纯度为 。(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O, I2+2S2O32-==2I-+S4O62-
②(NH4)2Cr2O7的摩尔质量为252g/moL)。
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.7×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为____________________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为_______________________。
(3)物质的量浓度均为0.1 mol·L-1的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是____________(填编号)。
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,
则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是_______________________。稀释后,HX溶液中由水电离出来的c(H+)_______(填“大于”、“等于”或“小于”)
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色),①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+
2H++ 2CrO42-(黄色),①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+ 2Cr3+(绿色) + 6Fe3+ + 7H2O。下列分析正确的是
2Cr3+(绿色) + 6Fe3+ + 7H2O。下列分析正确的是
| A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
| B.实验②能说明氧化性:Cr2O72-> Fe3+ |
| C.CrO42-和Fe2+在酸性溶液中可以大量共存 |
| D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
12分)许多尾气中含有NOX、SO2等造成空气污染的气体。根据要求回答下列问题:
(1)已知:NO2(g)+CO (g)  CO2 (g) +NO (g)。
CO2 (g) +NO (g)。
①密闭容器中发生该反应时,c(CO2)随温度(T)变化曲线如图所示。据此判断,升高温度,该反应的平衡常数 (选填“增大”、“减小”“不变”)。
②NO对臭氧层破坏会起催化作用,其主要过程为:Ⅰ.O3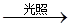 O+O2
O+O2
Ⅱ.NO+O3 →NO2+O2
Ⅲ. 。(请写出“Ⅲ”中的化学反应方程式。)
(2)将CO2和H2合成二甲醚(CH3OCH3)已取得了较大的进展,其化学反应为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①1g二甲醚气体完全燃烧生成两种气态氧化物,放出能量q kJ,请写出该反应的热化学方程式 ;
②二甲醚可以作为燃料电池的燃料,若用硫酸做电池中的电解质溶液,请写出该燃料电池工作时负极电极反应式 。
(3)室温条件下,用0.10mol·L-1盐酸分别滴定20.00mL浓度均为0.10mol·L-1的NaOH溶液和氨水,下图是滴定其中一种溶液时,所得混合液的pH与加入盐酸体积的关系曲线图。
①该曲线表示滴定 (填“NaOH”或“氨水”)的过程;
②当向20.00mLNaOH溶液中加入v mL盐酸时,所得混合溶液pH=12,则v = 。(保留2位小数)
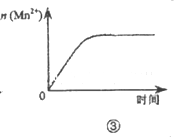
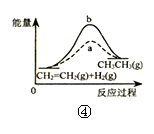
下列各表述与示意图一致的是( )
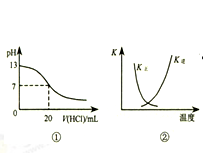
| A.图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| B.图②中曲线表示反应2SO2(g)+O2(g)⇌2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.0l mol•L-1KMnO4酸性溶液与过量的0.1 mol•L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
| A.盐酸多 | B.H2A多 | C.一样多 | D.无法确定 |
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
研究在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的主要以4种无机碳形式存在,其中
占95%,写出
溶于水产生
的方程式:。
(2)在海洋循环中,通过下图所示的途径固碳。

①写出钙化作用的离子方程式:。
②同位素示踪法证实光合作用释放出的只来自于
,用
标记物质的光合作用的化学方程式如下,将其补充完整:+=
+
+
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收,用
从酸化后的还说中吹出
并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。

②滴定。将吸收液洗后的无机碳转化为,再用
溶液滴定,消耗
溶液,海水中溶解无机碳的浓度=
。
(4)利用下图所示装置从海水中提取,有利于减少环境温室气体含量。

①结合方程式简述提取的原理:。
②用该装置产生的物质处理室排出的海水,合格后排回大海。处理至合格的方法是。
Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
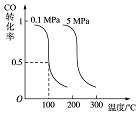
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率 (填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。

(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合且恰好呈中性,则混合前c(NaOH) c(CH3COOH)
(3)在D点,溶液中离子浓度大小关系为_____________________。
室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随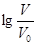 的变化如图所示。下列叙述正确的是( )
的变化如图所示。下列叙述正确的是( )
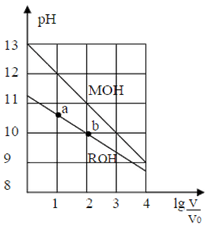
| A.稀释前两溶液的Ka:MOH溶液>ROH溶液 |
| B.ROH的电离程度:b点小于a点 |
| C.两溶液在稀释过程中,c(H+)均逐渐减少 |
D.当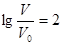 时,若两溶液同时升高温度,则 时,若两溶液同时升高温度,则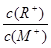 增大 增大 |
某温度(T℃)下的溶液中,c(H+)=10﹣x mol·L﹣1,c(OH﹣)=10﹣y mol·L﹣1,x与y的关系如图所示,请回答下列问题:
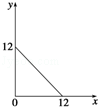
(1)此温度下,水的离子积Kw为 ,则该温度T 25(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
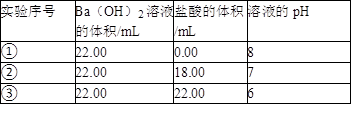
假设溶液混合前后的体积变化忽略不计,则a= ,实验②中由水电离产生的c(OH﹣)= mol·L﹣1.
(3)在此温度下,将0.1mol·L﹣1的NaHSO4溶液与0.1mol·L﹣1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
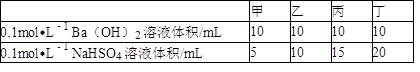
①按丁方式混合后,所得溶液显 (填“酸”、“碱”或“中”)性.
②写出按乙方式混合后,反应的离子方程式: .
③按甲方式混合后,所得溶液的pH为 .
氯酸钠(NaClO3)是无机盐工业的重要产品之一。
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的 (填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应3C12+6NaOH 5NaC1+NaC1O3+3H2O
5NaC1+NaC1O3+3H2O
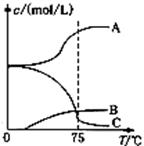
先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则反应化学方程式为: 。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL。
步骤4: 。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为 ;静置10min的目的是 。
②步骤3中K2Cr2O7标准溶液应盛放在 (填仪器名称)中。
③为精确测定样品中C1O3-的质量分数,步骤4操作为 。
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是 。
(1)常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=____________。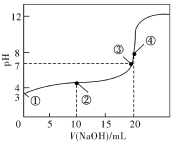
(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
0.01mol·L-1Na2SO3溶液中通人SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是___________________。
(3)向0.1mol·L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是____________________。
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加入1mol·L-1的H3PO4,请作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图像。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
注:NH4Fe(SO4)2是一种复盐。请回答下列问题:
(1)TiCl4水解生成TiO2·x H2O的化学方程式为_________________________。
(2)检验TiO2·x H2O中Cl-是否被除净的方法是_________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是______________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_______(填字母代号)。
(4)滴定终点的现象是__________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗C mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为___________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__ __。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
中国环境监测总站数据显示,PM2.5、SO2、NOx等是连续雾霾过程影响空气质量显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对它们进行研究具有重要意义。请回答:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH |
SO |
NO |
Cl- |
| 浓度(mol/L) |
4×10−6 |
6×10−6 |
2×10−5 |
4×10−5 |
3×10−5 |
2×10−5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
(3)消除氮氧化物和硫氧化物有多种方法。
Ⅰ.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
①由图可知SCR技术中的氧化剂为 。
②用Fe做催化剂时,在氨气足量的情况下,当 =1:1时,脱氮率最佳,已知每生成28g N2放出的热量为QkJ,该反应的热化学方程式为 。
=1:1时,脱氮率最佳,已知每生成28g N2放出的热量为QkJ,该反应的热化学方程式为 。
Ⅱ.工业上变“废”为宝,吸收工业中SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
①装置Ⅰ中的主要反应的离子方程式为 。
②装置Ⅲ还可以使Ce4+再生,若用甲烷燃料电池电解该装置中的溶液,当消耗1mol CH4时,
理论上可再生 mol Ce4+。
Ⅲ.用活性炭还原法可以处理氮氧化物。如发生反应:
C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ/mol。
N2(g)+CO2(g) △H=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 时间(min) 时间(min)浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.58 |
0.40 |
0.40 |
0.48 |
0.48 |
| N2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
| CO2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
①Tl℃时,该反应的平衡常数K= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(答一种即可)。