室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随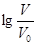 的变化如图所示。下列叙述正确的是( )
的变化如图所示。下列叙述正确的是( )
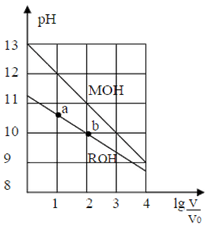
| A.稀释前两溶液的Ka:MOH溶液>ROH溶液 |
| B.ROH的电离程度:b点小于a点 |
| C.两溶液在稀释过程中,c(H+)均逐渐减少 |
D.当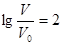 时,若两溶液同时升高温度,则 时,若两溶液同时升高温度,则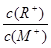 增大 增大 |
(原创) 酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1) 氨水是中学常见碱
① 下列事实可证明氨水是弱碱的是 (填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0. 1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0. 1mol·L-1氯化铵溶液的pH为5
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.通入氨气 B.加入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
① 滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(3)为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
| 步骤1:向2 mL 0.005 mol·L-1AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 |
出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1Fe(NO3)3溶液。 |
溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴 3 mol·L-1 AgNO3溶液。 |
现象a ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴 3 mol·L-1 KI溶液。 |
出现黄色沉淀。 |
已知:ⅠAgSCN是白色沉淀。
Ⅱ相同温度下,Ksp(AgI)= 8.3×10‾17,Ksp (AgSCN )= 1.0×10‾12 。
① 步骤3中现象a是 。
② 用沉淀溶解平衡原理解释步骤4的实验现象 。
③向50 mL 0.005 mol•L‾1的AgNO3溶液中加入150 mL0.005 mol•L‾1的 KSCN溶液,混合后溶液中Ag+的浓度约为 mol•L‾1。(忽略溶液体积变化)
某温度(T℃)下的溶液中,c(H+)=10﹣x mol·L﹣1,c(OH﹣)=10﹣y mol·L﹣1,x与y的关系如图所示,请回答下列问题:
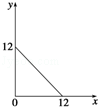
(1)此温度下,水的离子积Kw为 ,则该温度T 25(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
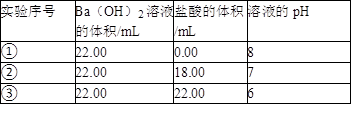
假设溶液混合前后的体积变化忽略不计,则a= ,实验②中由水电离产生的c(OH﹣)= mol·L﹣1.
(3)在此温度下,将0.1mol·L﹣1的NaHSO4溶液与0.1mol·L﹣1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
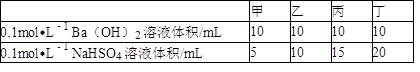
①按丁方式混合后,所得溶液显 (填“酸”、“碱”或“中”)性.
②写出按乙方式混合后,反应的离子方程式: .
③按甲方式混合后,所得溶液的pH为 .
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
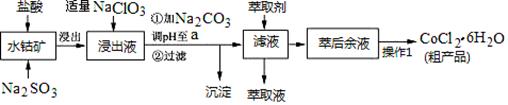
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式____________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________________。
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 |
Na+、Ba2+、NH |
| 阴离子 |
CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是______ ____,B是___ ___(填化学式) 。
用离子方程式表示A的水溶液中存在的平衡关系: 。
(2)写出C和D反应的离子方程式__________ _。
(3)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中:c(H+)-c(OH—)=_____ ____(填微粒浓度符号)=_____ ______(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 _。
(5)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _____。
(6)现使用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。在本实验的滴定过程中,下列操作会使实验结果偏大的是__ (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
碱式碳酸钴[ Cox(OH)y(CO3)z ]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
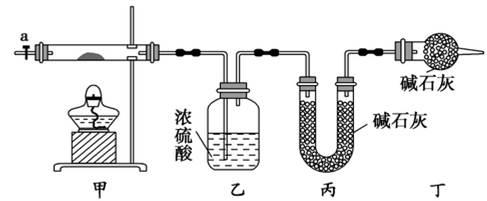
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_____________________
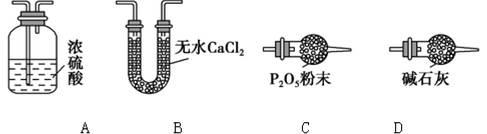
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的______(填字母)连接在_________(填装置连接位置)。
(4)若按正确装置进行实验,测得如下数据:
| |
乙装置的质量/g |
丙装置的质量/g |
| 加热前 |
80.00 |
62.00 |
| 加热后 |
80.36 |
62.88 |
则该碱式碳酸钴的化学式为_________________。
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为___________。
(6)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
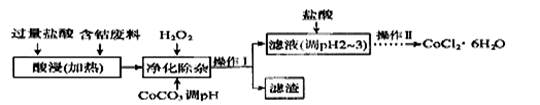
已知:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
CO(OH)2 |
Al(OH)2 |
| 开始沉淀(PH) |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀(PH) |
4.1 |
9.7 |
9.2 |
5.2 |
①净除杂质时,加入H2O2 发生反应的离子方程式为______________。
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________。
③加盐酸调整PH为2~3的目的为__________________________________。
④操作Ⅱ过程为___________(填操作名称)、过滤。
氯酸钠(NaClO3)是无机盐工业的重要产品之一。
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的 (填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应3C12+6NaOH 5NaC1+NaC1O3+3H2O
5NaC1+NaC1O3+3H2O
先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
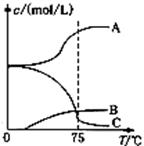
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则反应化学方程式为: 。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL。
步骤4: 。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为 ;静置10min的目的是 。
②步骤3中K2Cr2O7标准溶液应盛放在 (填仪器名称)中。
③为精确测定样品中C1O3-的质量分数,步骤4操作为 。
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是 。
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x的值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol·L-1的KMnO4标准溶液进行滴定,达到终点时消耗了10.00mL。
请回答下列问题:
(1)滴定时,将酸性KMnO4标准液装在如图中的 (填“甲”或“乙”)滴定管中。
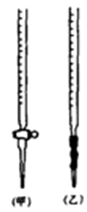
(2)本实验滴定达到终点的标志是 。
(3)通过上述数据,求得x= 。讨论:
①若滴定终点时俯视滴定管,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
铅及其化合物在工业生产生活中都具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)↑H="a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)↑H="b" kJ•mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)↑H="c" kJ•mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s)△H=_____________kJ•mol-1(用含a,b,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g) Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
| 温度 |
300 |
727 |
1227 |
| lgK |
6.17 |
2.87 |
1.24 |
①该还原反应的△H____0(选填:“>”“<”“=”)。
②当lgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为_______。
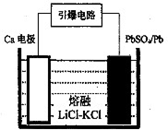
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为_______。
(4)PbI2:可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图).加入酚酞指示剂,用0.0025mol•L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时PbI2 Ksp为_______。
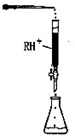
(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图1所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图2所示.
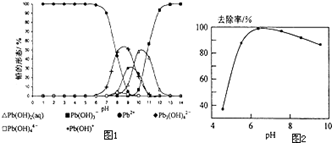
①常温下,pH=6→7时,铅形态间转化的离子方程式为____________________。
②用活性炭处理,铅的去除率较高时,铅主要应该处于________(填铅的一种形态的化学式)形态.
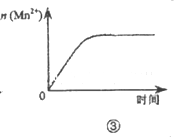
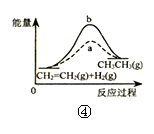
下列各表述与示意图一致的是( )
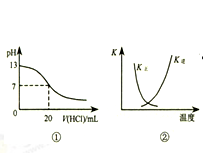
| A.图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| B.图②中曲线表示反应2SO2(g)+O2(g)⇌2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.0l mol•L-1KMnO4酸性溶液与过量的0.1 mol•L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
下列说法正确的是( )
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.室温下,水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
| C.相同温度下,等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为②>④>③>① |
| D.往0.1mol/LCH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中c(CH3COOH)/c(H+)·c(CH3COO-) 增大 |
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH)。下列判断正确的是( )
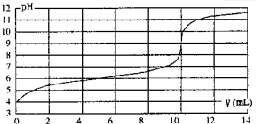
| A.HA的浓度为1×10-4mol•L-1 | B.实验时可选甲基橙作指示剂 |
| C.pH=7时,溶液中c(Na+)>c(A-) | D.V=10mL,酸碱恰好中和 |
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量。该同学选用的药品除样品外,还应有________;实验中应测定的数据有________。
(2)乙同学运用滴定法测定样品中NaOH的含量。
①用分析天平称取该样品5.000 g,全部溶于水配制成1 000.0 mL溶液。用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应________________。
②用浓度为0.100 0 mol·L-1的盐酸标准溶液进行滴定。开始滴定前的一步操作是___ _____。
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次。
④滴定过程中,锥形瓶中溶液的pH变化如下:
| V(HCl)/mL |
0.00 |
12.00 |
18.00 |
22.00 |
23.00 |
23.96 |
24.00 |
24.04 |
25.00 |
26.00 |
30.00 |
| pH |
13.1 |
12.6 |
12.2 |
11.7 |
11.4 |
9.9 |
7.0 |
4.0 |
2.7 |
2.4 |
1.9 |
请在坐标图中绘制出上述中和滴定的曲线。
| |
变色范围(pH) |
颜色 |
|
| 酸 |
碱 |
||
| 甲基橙 |
3.1~4.4 |
红 |
黄 |
| 石蕊 |
5.0~8.0 |
红 |
蓝 |
| 酚酞 |
8.2~10.0 |
无 |
红 |

⑤如上表所示是几种酸碱指示剂的变色范围,根据你所作的中和滴定曲线分析,上述中和滴定中应选用的指示剂是________。
⑥样品中,NaOH的质量百分含量为____________。
(3)以下滴定操作能导致最终滴定结果偏低的是( )
A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失
B.滴定结束后,仰视读取酸式滴定管的数据
C.锥形瓶内盛装待测液之前有少量蒸馏水
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来
E.酸式滴定管使用前未润洗
F.碱式滴定管使用前未润洗
I.(1)H3PO2是一元中强酸,写出其电离方程式_________________________________。
(2)③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显______(填“酸性”、“中性”或“碱性”)。
II.现有pH=2的醋酸甲和pH=2的盐酸乙:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;若加入少量的冰醋酸,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动,若加入少量无水醋酸钠固体,待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液混合,溶液的pH=___ ___,若两溶液不等体积混合,则
pH___ ___。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)________ V(乙) ( 填“>”、“<”或“=”)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)________ c(CH3COO-) ( 填“>”、“<”或“=”)。
(1)常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=____________。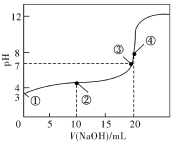
(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
0.01mol·L-1Na2SO3溶液中通人SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是___________________。
(3)向0.1mol·L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是____________________。
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加入1mol·L-1的H3PO4,请作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图像。