已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径 A>B>D>C | B.原子序数 d>c>d>a |
| C.离子半径 C>D>B>A | D.单质的还原性 A>B>D>C |
根据下列反应判断有关的物质还原性由强到弱的顺序是
H2SO3+I2+H2O=2HI+H2SO4、2FeCl3+2HI=2FeCl2+2HCl+I2、3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO | B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO | D.NO>Fe2+>H2SO3>I- |
自然界存在NaIO3,可利用NaIO3与NaHSO3溶液来制取单质碘。反应分两步进行:IO3-+3HSO3-=I-+3SO42-+3H+;IO3-+5I-+6H+=3I2+3H2O。下列说法错误的是
| A.NaIO3是氧化剂,HSO3-是还原剂 |
| B.生产中可得到副产物H2SO4和Na2SO4 |
| C.I2既是氧化产物又是还原产物 |
| D.HSO3-的还原性比I- 弱 |
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关,下列各组物质:
①Cu和HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是
| A.①③ | B.③④ | C.①② | D.①③④ |
将甲、乙两种金属的性质相比较,已知:
①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低。能说明甲的金属性比乙强的是
| A.①④ | B.①②③ | C.③⑤ | D.①②③④⑤ |
【改编】下列判断中一定正确的是
| A.若A2+2D-=2A-+D2,则氧化性:A2>D2 |
| B.40K和40Ca原子中质子数和中子数相等 |
| C.某物质中只含有一种元素,该物质一定是纯净物 |
| D.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N |
反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2。
下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.反应①、②中生成等量的I2时转移电子数比为1︰5 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.碘元素在反应①中被还原,在反应②中被氧化 |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO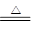 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 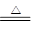 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.酸性(水溶液):HSCN > H2CO3 > HCN |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是
| 选项化合物 |
A |
B |
C |
D |
| Y |
CO2 |
Fe2O3 |
SiO2 |
FeCl3 |
| W |
MgO |
Al2O3 |
CO |
CuCl2 |
已知I2+SO32-+H2O===SO42-+2I-+2H+。某无色溶液中只可能含有I-,NH4+,Ba2+, SO32-,MnO4-中的一种或几种,若向该溶液中滴加少量的溴水,溶液仍为无色,下列判断正确的是
| A.该溶液中肯定不含I- | B.该溶液中可能含有Ba2+ |
| C.该溶液中肯定含有NH4+ | D.该溶液中可能含有MnO4- |
下图为中学化学实验中的常见实验装置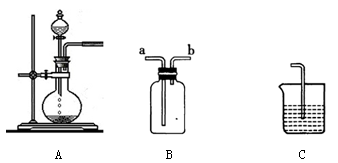
(1)装置A可用于制备多种气体,请写出用A装置制备下列气体时,圆底烧瓶和分液漏斗中应装的化学试剂
| 气体 |
O2 |
CO2 |
HCl |
| 试剂 |
|
|
|
(2)装置B可用于收集多种气体,若要用于收集Cl2,则进气管为________;若要收集CO,简述用装置B收集CO的方法________________________________
(3)现要用上述装置制取Cl2,并设计实验比较Cl2和I2的氧化性强弱,请在表格内依次填上所需的装置和试剂(可不填满)
| 装置 |
该装置中反应的离子方程式 |
| |
|
| |
|
| |
|
| |
|
某溶液中含有HCO3-、SO32-、CH3COO-、CO32-四种离子,若向其中加入Na2O2后,溶液
中离子浓度基本保持不变的是
| A.HCO3- | B.SO32- | C.CH3COO- | D.CO32- |
利用下图装置进行实验(必要时可加热),不能得出相应结论的是
| |
溶液① |
固体② |
溶液③ |
实验结论 |
 |
| A |
稀硫酸 |
Na2CO3 |
Na2SiO3 |
非金属性:C>Si |
|
| B |
浓盐酸 |
MnO2 |
Na2S |
氧化性:Cl2>S |
|
| C |
盐酸 |
CaCO3 |
C6H5ONa |
酸性:碳酸>苯酚 |
|
| D |
稀硫酸 |
Na2CO3 |
CaCl2 |
CO2不与氯化钙反应 |
下列比较中,正确的是
| A.原子半径:Na>Mg | B.碱性:NaOH>KOH |
| C.结合H+的能力:CO32¯<Cl¯ | D.还原性:I¯<Br¯ |