下表中叙述Ⅰ和叙述Ⅱ均正确并且互为因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
NH4Cl是强酸弱碱盐 |
将NH4Cl溶液蒸干可制备NH4Cl固体 |
| B |
Fe3+有强氧化性 |
用KSCN溶液可以鉴别Fe3+ |
| C |
SO2有还原性 |
用SO2可使溴水褪色 |
| D |
Cl2有漂白性 |
用Cl2可与石灰乳反应制备含氯消毒剂 |
下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液 |
有白色沉淀生成 |
该溶液中一定含有Ag+ |
| B |
向AgNO3溶液中滴加过量氨水 |
溶液澄清 |
Ag+与NH3∙H2O能大量共存 |
| C |
用石墨作电极电解MgSO4溶液 |
某电极附近有白色沉淀生成 |
该电极为阳极 |
| D |
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 |
下层溶液显紫红色 |
氧化性:Fe3+>I2 |
下列实验操作和对应的现象、结论都正确的是
| 选项 |
操 作 |
现 象 |
结 论 |
| A |
在滴有酚酞的Na2CO3溶液中加入BaC12溶液 |
红色褪去 |
Na2CO3溶液中存在水解平衡 |
| B |
将某气体通入品红溶液中 |
品红溶液褪色 |
该气体一定是SO2 |
| C |
将铜板电路投入FeCl3溶液中 |
铜溶于FeCl3溶液 |
氧化性:Fe3+ > Cu2+ |
| D |
向NaCl溶液滴少量AgNO3溶液,再滴加少量NaI溶液 |
先有白色沉淀,后变成黄色沉淀 |
Ksp(AgI) >Ksp(AgCl) |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通人 SO2气体,溶液逐渐变成无色。下列分析正确的是
| A.滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀 |
| B.通入SO2后溶液逐渐变成无色,体现了 SO2的漂白性 |
| C.通入SO2时,SO2与I2反应,I2作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+ >I2 > SO2 |
根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是
①Cl2+2KI===I2+2KCl ②2FeCl3+2HI===I2+2FeCl2+2HCl
③2FeCl2+Cl2===2FeCl3 ④I2+SO2+2H2O===2HI+H2SO4
| A.Cl2>I2>Fe3+>SO2 | B.Fe3+>Cl2>I2>SO2 |
| C.Cl2>Fe3+>I2>SO2 | D.Cl2>Fe3+>SO2>I2 |
根据反应式:①2Fe3++2I- 2Fe2++I2和② Br2+2Fe2+
2Fe2++I2和② Br2+2Fe2+ 2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- |
| C.Br-、I-、Fe2+ | D.Fe2+、I-、Br- |
(12分)根据下图所示的关系,确定A、B、C、D、E、F的化学式,并写有关方程式。
(1)已知A为单质,则A为 (填化学式,下同),E为 。
(2)D→E的化学方程式为___________________________________。
(3)取少量C溶于水,加入酸化的硝酸银溶液,有白 色沉淀生成,则A→C的化学方程式为_____________________________。
(4)某学习小组设计如下装置进行相关实验:
①打开活塞b,向溶液B中逐滴加入少量溴水,关闭活塞b;
②打开活塞a,向容器中滴入足量的亚硫酸。
按要求回答下列问题:
①滴入溴水时,溶液的颜色变为棕黄色,该反应的离子方程式为________。
②滴入亚硫酸时,溶液由棕黄色变为浅绿色,该反应的离子方程式为______。
③由此可知,B中的阳离子、Br-、H2SO3还原性由强到弱的顺序是___________(B中的阳离子用离子符号表示)。
新型纳米材料MFe2O,(3<x <4)中M表示十2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程为:
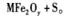 下列判断正确的是
下列判断正确的是
| A.MFe2Ox是还原剂 | B.SO2被氧化 |
| C.x>y | D.氧化性:MFe2Oy>SO2 |
将112mLCl2(标准状况)通入10mL1mol/L的FeBr2溶液中(还原性:Fe2+大于Br-),发生反应的离子方程式是
| A.Cl2+2Br-=2Cl-+Br2 | B.2Fe2++Cl2=2Fe3++2Cl- |
| C.2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | D.2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是
| 选项 |
规律 |
结论 |
| A |
较强酸可以制取较弱酸 |
用亚硫酸溶液无法制取硫酸溶液 |
| B |
升高温度,反应速率越快 |
常温下钠与氧气反应生成氧化钠,升高温度,Na2O的生成速率加快 |
| C |
金属越活泼,其阳离子氧化性越弱 |
Fe3+的氧化性弱于Cu2+ |
| D |
Ksp小的沉淀易向Ksp更小的沉淀转化 |
CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀 |
铋(Bi)位于元素周期表中ⅤA族,其价态为+3价较稳定,铋酸钠(NaBiO3)溶液呈无色,取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
关于NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为
A.I2、H2O2、KMnO4、NaBiO3 B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2 D.KMnO4、NaBiO3、I2、H2O2
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色,再向反应后的溶液中通入过量SO2,溶液变成无色。下列说法正确的是(NA表示阿伏加德罗常数的值)
| A.滴加KI溶液时,KI被氧化,CuI是氧化产物 |
| B.当有22.4 L SO2参加反应时,有2NA个电子发生转移 |
| C.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
| D.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易被氧化变暗,且受热易燃烧,遇水很快反应。下列说法正确的是(已知:铈常见的化合价有+3和+4,氧化性:Ce4+>Fe3+)
| A.电解熔融CeO2制Ce时,铈在阳极获得 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ |
D.Ce有四种稳定的核素嚣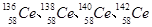 ,它们互称为同位素 ,它们互称为同位素 |