北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ/mol
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=+32.4kJ/mol
则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH =5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3 HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mo1/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用简要的文字明)。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
请回答下列有关含氮物质的问题:
(1)右图是1molNO2和1molCO反应生成CO2 和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_____________________________________;
恒温恒容条件下,不能说明该反应已达到平衡状态的是___(填序号)。
| A.容器内混合气体颜色不再变化 |
| B.容器内的压强保持不变 |
| C.v逆(NO2)=v正(NO) |
| D.容器内混合气体密度保持不变 |
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2 = N2+2H2O。该电池放电时,负极的电极反应式是_________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_____________________________________。
美国一个海军航空站安装了一台250 kW的MCFC型燃料电池。该电池可同时供应电和蒸汽,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~800 ℃。已知该电池的总反应为2H2+O2 2H2O,负极反应为H2+
2H2O,负极反应为H2+ -2e-
-2e- H2O+CO2。下列推断正确的是
H2O+CO2。下列推断正确的是
A.正极反应为4OH--4e- O2↑+2H2O O2↑+2H2O |
B.放电时, 向负极移动 向负极移动 |
| C.电池供应1 mol水蒸气,转移的电子的物质的量为4 mol |
D.放电时 向正极移动 向正极移动 |
肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g) =N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g) = N2(g)+2H2O(g)ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式_________________________________;
(2)上述反应中氧化剂是 。
(3)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4(g) 2NO2(g)
2NO2(g)
① 上述反应的ΔH 0(选填“>”或“<”)。
② 保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,再次达到平衡时,混合气体中NO2的体积分数 (填“增大”、“ 减小”或“不变”),混合气体的颜色 (填“变深”或“变浅”)。
③一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是 。

④若在相同温度下,上述反应改在体积为10L的恒容密闭容器中进行,反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=_______mol·L-1·s-1。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为______。
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol 电子 3H2+CO,每消耗1molCH4转移12mol 电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
(12分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H =-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。

①能说明该反应已达平衡状态的是________
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1, 且保持不变
②下列措施中能使 增大的是________ (选填编号)。
增大的是________ (选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=___________ , 若改变条件 (填选项),可使K=1。
A增大压强 B增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
|
(2)某甲醇燃料电池原理如图1所示:M区发生反应的电极反应式为_______________________________。

我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi LixV2O5。下列说法中正确的是
LixV2O5。下列说法中正确的是
| A.锂在放电时做正极材料,充电时为阳极材料 |
| B.电池在放电时,Li+向负极移动 |
| C.该电池充电时阳极的反应为:LixV2O5-xe-=V2O5 + xLi+ |
| D.V2O5只是锂发生反应的载体,不参与电池反应 |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如下图所示。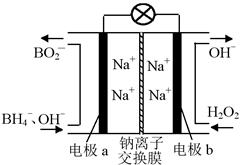
下列说法错误的是( )
| A.电池放电时Na+从a极区移向b极区 |
| B.电极b采用MnO2,MnO2既作电极材料又有催化作用 |
C.该电池的负极反应为:BH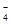 +8OH--8e-=BO +8OH--8e-=BO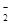 +6H2O +6H2O |
| D.每消耗3 mol H2O2,转移的电子为3 mol |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,
KOH作为电解质。下列关于该燃料电池的叙述不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4+4OH--4e - =N2+4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为
2AgNO3+4KOH+K2S2O8 Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式: .
(3)准确称取上述制备的样品(设仅含Ag2O2和Ag2O) 2.558g,在一定的条件下完全分解为Ag 和O2,得到224.0mLO2(标准状况下).计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位).
科学家开发出一种新型锂—氧电池,其能量密度极高,效率达90%以上。电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O 2I2+4LiOH
2I2+4LiOH
对于该电池的下列说法不正确的是
| A.放电时负极上I-被氧化 |
| B.充电时Li+从阳极区移向阴极区 |
| C.充电时阴极反应为LiOH+e-==Li+OH- |
| D.放电时正极反应为O2+2H2O+4Li++4e-==4LiOH |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH
溶液,其充、放电过程按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2,
Cd(OH)2 + 2Ni(OH)2,
有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e—+ OH—="=" NiOOH + H2O |
| B.充电过程中镉元素被氧化 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH—向正极移动 |
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高.
(1)若电解质溶液为KOH溶液,其正极反应为 ,负极反应为 ﹣ ;
(2)若电解质溶液为硫酸,其正极反应为 ,负极反应为 ;若反应过程中转移了2mol电子,可产生水的质量为 g.
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol•L﹣1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体.此时氢氧燃料电池外电路中转移电子数为 ,消耗H2的质量为 g.
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:ZN(s)+2MNO2(s)+H2O(l)﹦ZN(OH)2(s)+MN2O3(s)。下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MNO2(s)+H2O(l)+2e-﹦MN2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |