镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点。其中一种镁电池的反应原理为: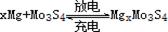 。下列说法不正确的是
。下列说法不正确的是
| A.放电时,Mo3S4发生氧化反应 |
| B.放电时,正极反应式:Mo3S4+2xe-→Mo3S42x- |
| C.充电时,Mg2+向阴极迁移 |
| D.充电时,阴极反应式:xMg2++2xe-→xMg |
近年来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O 2 →2CO 2+ 3H2O.下列说法不正确的是( )
A.1mol乙醇被氧化转移6mol电子
B.C2H5OH在电池的负极上参加反应
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应式为4H++O2+4e-=2H2O
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.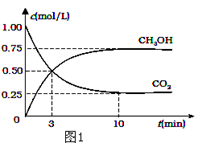
(1)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol/(L•min);
②氢气平衡时的物质的量浓度为___________;
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________.
| A.升高温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 |
| D.再充入1mol CO2和3mol H2 |
④当反应达到平衡时, H2的物质的量浓度为c1,然后向容器中再加入1mol CH3OH和1mol H2O,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1______c2的关系(填>、<、=).
(2)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答: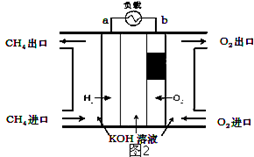
①通入甲烷一极的电极反应式为___________;
②随着电池不断放电,电解质溶液的pH______(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率___________(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
铁镍蓄电池其化学反应原理为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH) 2下列有关该电
Fe(OH)2+2Ni(OH) 2下列有关该电
池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M =" NiOOH" + MH。已知:6NiOOH + NH3 + H2O + OH-="6" Ni(OH)2 + NO2-
下列说法正确的是
| A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH- |
| B.充电过程中OH-离子从阳极向阴极迁移 |
| C.充电过程中阴极的电极反应式:H2O + M + e-=" MH" + OH-,H2O中的H被M还原 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
下列说法不正确的是
| A.放电时,电极A为负极 |
| B.根据上表数据,该电池工作的适宜温度应控制在350~2050℃ |
| C.充电时,Na+的移动方向为从电极B到电极A |
| D.充电时,总反应为Na2Sx==2Na+xS(3<x<5),则阳极的电极反应式为Sx-2e-==xS |
(1)已知N≡N、N﹣H、H﹣H的键能分别为946kJ•mol﹣1、390kJ•mol﹣1、436kJ•mol﹣1.试根据盖斯定律,写出合成氨反应的热化学方程式__________________________________________。
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,写出该反应中和热的热化学方程式______________________________________________________。
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做负极,其电极反应式为__________;
与MnO2﹣Zn电池类似,K2FeO4﹣Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,在反应中还原产物为Fe(OH)3 ,则正极电极反应式为__________________________________________。
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e- + OH- ="NiOOH" + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH -向正极移动 |
近来,制备和利用氢气这一清洁能源已有多项成果。
(1)德国克莱斯公司成功研制了甲醇(CH3OH)制氢车载燃料电池工艺,其原理如下流程图所示:

①流程图中,甲醇与水在选择氧化器中反应生成二氧化碳和氢气,写出该反应的化学方程式
②该车载燃料电池的介质为碱性环境,请写出该燃料电池的正极反应式为
(2)美国Bay等工厂成功研制了以甲烷来制取氢气,其生产流程如下图:

①此流程的第Ⅱ步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式K=
H2(g)+CO2(g),该反应的化学平衡常数表达式K=
②此流程的第Ⅱ步反应的平衡常数随温度的变化如下表,在830 ℃、以表中的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
| 温度/℃ |
400 |
500 |
830 |
1 000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
| 实验编号 |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
0 |
| D |
0.5 |
2 |
1 |
1 |
③若400 ℃时,第Ⅱ步反应生成1 mol氢气的热效应值为33.2kJ,第Ⅰ步反应的热化学方程式为:CH4(g) + H2O(g) === 3H2(g) + CO(g) ΔH=-103.3 kJ·mol-1则400 ℃时,甲烷和水蒸反应生成二氧化碳和氢气的热化学方程式为:
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,下图是三种催化剂在光照分解水实验中的效果比较图。

要得出如图所示的实验结果,需要测定的实验数据是 ,本实验的目的是 。
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2+M = NiOOH+MH已知:6NiOOH+NH3+H2O+OH-=6Ni(OH)2+NO2-。下列说法正确的是
| A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-= Ni(OH)2+OH- |
| B.充电过程中OH-离子从阳极向阴极迁移 |
| C.充电过程中阴极的电极反应式:H2O+M+e-= MH+OH-,H2O中的H被M还原 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
已知:锂离子电池的总反应为: C+LiCoO2;锂硫电池的总反应为:2Li+S
C+LiCoO2;锂硫电池的总反应为:2Li+S Li2S有关上述两种电池说法正确的是( )
Li2S有关上述两种电池说法正确的是( )

| A.锂离子电池放电时,Li+向负极迁移 |
| B.锂硫电池充电时,锂电极发生还原反应 |
| C.理论上两种电池的比能量相同 |
| D.右图中表示用锂离子电池给锂硫电池充电 |
铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,
工作原理为 下列说法一定正确的是
下列说法一定正确的是
| A.电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D.电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol·L-1 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O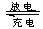 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是:
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是:
| A.放电时负极反应为: Zn-2e―+2OH―=Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3-3e―+5OH―=FeO42-+4H2O |
| C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D.放电时的正极在充电时须接电源正极 |
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g) 2H2(g)+O2(g)△H=+484kJ•mol﹣1,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H=+484kJ•mol﹣1,不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
上述反应过程中能量转化形式为光能转化为 能,达平衡过程中至少需要吸收光能为 kJ(保留三位小数)。
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:

则1mol N﹣H键断裂吸收的能量约等于 。
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气和氮气反应的热化学方程式是 。
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 H2+2NiO(OH)  2Ni(OH)2。请由总反应式回答:
2Ni(OH)2。请由总反应式回答:
1.电解质溶液应该是 (选填酸溶液、碱溶液),
②.电池放电时,负极反应式为 ,
3.外电路中每通过0.2NA个电子时,H2的质量理论上减小 g,
4.电池工作时,电子由 极通过外电路流向 极(选填正、负)。