已知外电路中,电子由铜流向a极。有关下图所示装置的分析中,合理的一项是
| A.一段时间后Zn电极逐渐溶解 |
| B.该装置中Cu极为正极,发生还原反应 |
| C.b极反应的电极反应式为:H2-2e-=2H+ |
D.电流方向: |
目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O。下列关于该电池的说法正确的是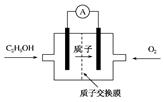
| A.通入乙醇的电极为该电池的正极 |
| B.放电过程中,电源内部的H+从正极区向负极区迁移 |
| C.该电池的正极反应为:4H++O2+4e—=2H2O |
| D.用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L |
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2 C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是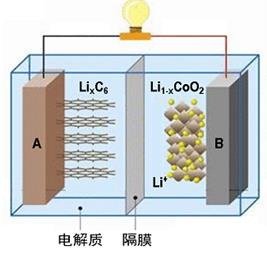
| A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边 |
| B.放电时,正极锂的化合价未发生改变 |
| C.充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是____ 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
①该电池的总反应化学方程式为____ ;
②电池中NaCI的作用是 。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为 。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCI溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 。
大功率Al H2O2动力电池原理如图所示,下列说法不正确的是

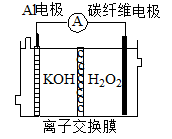
| A.电池组成中Al电极是负极 |
| B.OH-从碳纤维电极透过离子交换膜移向Al电极 |
| C.碳纤维电极的电极反应是H2O2+2e-+2H+=2H2O |
| D.该电池反应的离子方程式是2Al+3H2O2+2OH-=2Al(OH)4- |
某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,
Fe(OH)2+Ni(OH)2,
下列说法中正确的是
| A.放电时,负极上发生反应的物质是Fe |
B.放电时,正极反应是:NiO2+2e—+2H+ Ni(OH)2 Ni(OH)2 |
C.充电时,阴极反应是:Ni(OH)2-2e—+2OH— NiO2+2H2O NiO2+2H2O |
| D.充电时,阳极应该是镍元素化合价降低 |
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为V2+-e-=V3+,下列说法正确的是( )

| A.放电时,右槽发生还原反应 |
| B.放电时,左槽电解液pH升高 |
| C.充电时,阴极的电极反应式:VO2++2H++e-=VO2++H2O |
| D.充电时,每转移1 mol电子,n(H+)的变化量为1 mol |
(16分)运用化学原理知识研究化学对于人类的生产生活、科研意义重大。
(1)工业上以黄铜矿(主要成分:CuFeS2,其中S为-2价)为原料,采用火法熔炼工艺生产粗铜。CuFeS2中Fe的化合价为_____,熔炼过程中所得炉渣的主要成分有FeO、Fe2O3、SiO2,Al2O3等,若要利用炉渣制取铁红,下列实验操作不需要的是_____(填写字母代号)。
| A.溶解 | B.过滤 | C.蒸发结晶 | D.灼烧 |
(2)Mg(OH)2是水垢的主要成分之一,用氯化铵溶液浸泡:可以溶解Mg(OH)2,请结合平衡移动原理解释其原因_____。
(3)研究发现CuCl2溶液中铜、氯元素的存在形式为Cu(H2O)42+、CuCl42-,电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,阴极析出红色物质,试计算该过程中共转移电子____mol,若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入________。
(4)以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2。其工作原理如图所示。电池放电时Na+由____(填写“a”或“b”,下同)极区移向___________极区,该电池的负极反应式为__________________________________。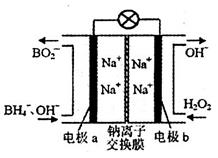
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极 FePO4+Li++e﹣=LiFePO4; 负极 Li﹣e﹣=Li+下列说法中正确的是( )
| A.充电时电池反应为FePO4+Li=LiFePO4 |
| B.充电时动力电池上标注“+”的电极应与外接电源的负极相连 |
| C.放电时电池内部Li+向正极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H 1=" -" 90.7 kJ·mol-1
CH3OH(g) △H 1=" -" 90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3 =" -" 41.2 kJ·mol-1
CO2(g)+H2(g) △H3 =" -" 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是 。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为 。
(4)图为绿色电“二甲醚燃料电池”的工作原理示意图。
该电池工作时,H+向 极移动(填“正”或“负”);a电极的电极反应式为 。
某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用下图实验装置(两电极均为石墨电极)电解 溶液来制取
溶液来制取 、
、 、
、 和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
(1)该电解槽的阳极反应式为 ,此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2)制得的 溶液从出口 (填“A”、“B”、“C”或“D”)导出。
溶液从出口 (填“A”、“B”、“C”或“D”)导出。
(3)利用制得的氢气为基本原料合成出甲醇,然后再用甲醇与氧气、氢氧化钠组成燃料电池,则该电池负极的电极反应式为 。
聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) |
Ala/% |
Alb/% |
A1c/% |
| 0.208 |
1.4 |
86.6 |
12.0 |
| 0.489 |
2.3 |
86.2 |
11.5 |
| 0.884 |
2.3 |
88.1 |
9.6 |
| 1.613 |
3.1 |
87.0 |
9.9 |
| 2.520 |
4.5 |
88.2 |
7.3 |
①在一定温度下,AlT越大,pH (填“越大”、“越小”或“不变”)。
②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: 。
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1。当T>80℃时,AlT显著下降的原因是 。
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1 =" a" kJ·mol-1
②3AlCl(g) =" 2Al(l)+" AlCl3(g) △H2 =" b" kJ·mol-1
则反应Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g) △H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H 0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图2所示,写出该电池正极的电极反应式 。
用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是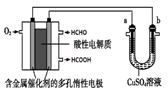
| A.当a、b都是铜做电极时,电解的总反应方程式为: 2CuSO4+2H2O  2H2SO4+2Cu+O2↑ 2H2SO4+2Cu+O2↑ |
| B.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH— |
| C.当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mole- |
| D.燃料电池工作时,负极反应为:HCHO+ H2O—2e-=HCOOH + 2H+ |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是
A.该电池的负极反应为   |
| B.电池放电时Na+从b极区移向a极区 |
| C.每消耗3 mol H2O2,转移的电子为3 mol |
| D.电极a采用MnO2作电极材料 |
(16分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1) 将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH |
SO |
NO |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
(3) 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_____________________。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。