某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。下列说法正确的是
| A.此电池在常温时也能工作 |
| B.正极电极反应式为:O2+2CO2+4e﹣=2CO32﹣ |
| C.CO32﹣向正极移动 |
| D.a为CH4,b为CO2 |
丙烷(C3H8)和丙烯(C3H6)都可作火炬燃料。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH3CH CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC CH(g ) △H2=+32.4 kJ·mol-1
CH(g ) △H2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)= CH3CH CH2(g)+H2(g)的△H= kJ·mol-1。
CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池负极反应式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中:
①c(OH-)= 。
②c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)“镁-次氯酸盐”燃料电池的装置如下图所示: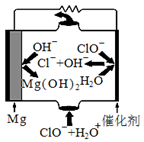
该电池的正极反应式为 。
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)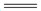 MgH2(s) △H1=-74.5kJ·mol-1
MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)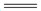 Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s)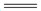 2Mg(s)+Mg2NiH4(s)的△H3= 。
2Mg(s)+Mg2NiH4(s)的△H3= 。
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下: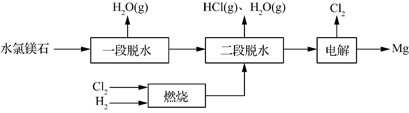
①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。
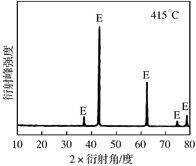
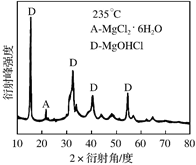
测得E中Mg元素质量分数为60.0%,则E的化学式为 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 。
(4)储氢材料Mg(AlH4)2在110~200°C的反应为:Mg(AlH4)2 MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
(1 6分)钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、
Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下: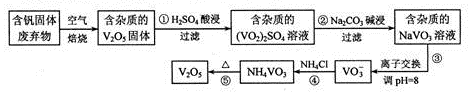
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为
(4)250C、101 kPa时,
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。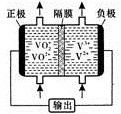
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2 VO2++ H2C2O4+2 H+="2" VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(V02)2S04溶液中钒的含量为 g/L。
(16分)天然气在生产、生活中具有广泛的应用。
(1)CO2(g)+4H2(g) CH4(g)+2H2O(g) △H="-162" kJ·mol-1。其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1> T2、则Pl ____P2 (填“>”“<”或“=”),平衡常数K1______K2(填“>” “<”或“=”)。
CH4(g)+2H2O(g) △H="-162" kJ·mol-1。其他条件相同,实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1> T2、则Pl ____P2 (填“>”“<”或“=”),平衡常数K1______K2(填“>” “<”或“=”)。
(2)另一合成CH4的原理:CO(g)+3H2(g) CH4(g)+H2O(g)。某温度时将0.1molCO和0.3mol H2充入10L的密闭容器内,l0min时达平衡。测得10min内v(CO)= 0.0009mol·L-1·min-1,则H2的平衡转化率为______,该温度下反应的平衡常数为___________mol-2·L2。
CH4(g)+H2O(g)。某温度时将0.1molCO和0.3mol H2充入10L的密闭容器内,l0min时达平衡。测得10min内v(CO)= 0.0009mol·L-1·min-1,则H2的平衡转化率为______,该温度下反应的平衡常数为___________mol-2·L2。
(3)某实验小组依据甲烷燃烧的反应原理,设计如图所示的装置。已知甲池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,乙池中盛有1L lmo1·L-1CuSO4溶液。a电极通入的气体为CH4,其电极反应式是______,b电极的现象为______。一段时间内乙池中溶液的pH由2变为1,则在这段时间内转移电子的物质的量为________mol。
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol 电子 3H2+CO,每消耗1molCH4转移12mol 电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
某模拟"人工树叶"电化学实验装置如图所示,该装置能将和
转化为
和燃料(
)。下列说法正确的是()

| A. | 该装置将化学能转化为光能和电能 |
| B. |
该装置工作时,
|
| C. |
每生成
|
| D. |
|
海洋电池,是以铝合金为电池负极,金属(Pt、Fe)网为正极,科学家把正极制成仿鱼鳃的网状结构。用海水为电解质溶液,它靠海水中的溶解氧与铝反应产生电能的。海水中只含有0.5%的溶解氧。不放入海洋时,铝极就不会在空气中被氧化,可以长期储存。用时,把电池放入海水中,便可供电, 电池设计使用周期可长达一年以上,避免经常交换电池的麻烦。即使更换,也只是换一块铝合金板,电池总反应式:4Al+3O2十6H2O=4Al(OH)3↓下列说法错误的是
| A.负极铝被氧化 |
| B.海水温度升高,电池反应速率可能加快 |
| C.正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气接触面积 |
| D.正极电极反应式为O2+4H+ +4e-=2H2O |
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
| A.蓄电池放电时,电路中每转移2 mol电子,最多有1 molPbO2被还原 |
| B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
| C.电解后,c(Na2SO4)不变,且溶液中有晶体析出 |
| D.蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O |
(17分)金属作为一种能源受到越来越多的关注。
(1)起始阶段,金属主要作为燃料的添加剂。如航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料,加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解:4NH4ClO4 6H2O↑+2N2↑+4HCl↑+5O2↑,在该反应中还原产物与氧化产物的物质的量比为_______,每有1molNH4ClO4分解,转移电子的物质的量为__________。
6H2O↑+2N2↑+4HCl↑+5O2↑,在该反应中还原产物与氧化产物的物质的量比为_______,每有1molNH4ClO4分解,转移电子的物质的量为__________。
(2)随着研究的深入,金属燃料直接作为能源出现。
①铁和铝的燃烧可以提供大量能量。
已知:4Al(s)+3O2(g)=2Al2O3(s) △H 1;3Fe(s)+2O2(g)=Fe3O4(s) △H 2
则相同质量的铝和铁完全燃烧,铝提供能量是铁提供能量的_____倍(用△H 1和△H 2表示)。
②关于金属燃料的下列说法错误的是________
a.较易控制金属燃烧后产物,减少对环境的污染
b.镁可以通过与二氧化碳的反应,达到既节能又减碳的效果
c.将金属加工为纳米金属时,表面积增大更容易燃烧
d.电解法冶炼镁铝的技术比较成熟,制取的镁铝可作为燃料用于发电
(3)相比金属燃料来讲,将金属中的化学能转化为电能在现在得到了更为广泛的应用。
①下图为某银锌电池的装置图,则该装置工作时,负极区pH______(填“增大”、“减小”或“不变),正极反应式为__________________。
②一种新型电池是以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质,放、充电的总反应式可表示为Li+LiFeSiO4 Li2FeSiO4。放电时,Li+向________(填“正”或“负”)极移动;充电时,每生成1mol LiFeSiO4转移_________mol电子。
Li2FeSiO4。放电时,Li+向________(填“正”或“负”)极移动;充电时,每生成1mol LiFeSiO4转移_________mol电子。
一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:
2CO(g)+O2(g) 2CO2(g) △H1=-566.0kJ·mol-1;
2CO2(g) △H1=-566.0kJ·mol-1;
S(s)+O2(g) SO2(g) △H2=-296.0kJ·mol-1;
SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______ 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为____,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为____反应(填“吸热”或“放热”);
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为____,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为____反应(填“吸热”或“放热”);
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的____极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:
CH3CH2OH+O2=CH3COOH+H2O。下列有关说法不正确的是
| A.检测时,电解质溶液中的H+向正极移动 |
| B.若有0.4mol电子转移,则消耗2.24L氧气 |
| C.正极上发生还原反应,负极上发生氧化反应 |
| D.负极上的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
铁及其化合物有着广泛用途。
(1)将饱和三氯化铁溶液滴加至沸水中可制取氢氧化铁胶体,写出制取氢氧化铁胶体的化学方程式 。
(2)含有Cr2O72-的废水有毒,对人畜造成极大的危害,可加入一定量的硫酸亚铁和硫酸使Cr2O72-转化为Cr3+,该反应的离子方程式为 。然后再加入碱调节溶液的pH在6-8 之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
(3)铁镍蓄电池又称爱迪生蓄电池,放电时的总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,充电时阳极附近的pH (填:降低、升高或不变),放电时负极的电极反应式为 。
(4)氧化铁是重要的工业原料,用废铁屑制备氧化铁流程如下: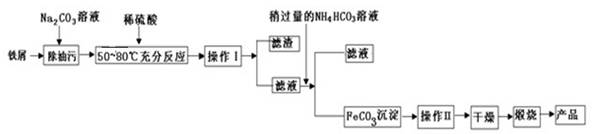
①铁屑溶于稀硫酸温度控制在50~800C的主要目的是 。
②写出在空气中煅烧FeCO3的化学方程式为 。
③FeCO3沉淀表面会吸附S042-,需要洗涤除去。
洗涤FeCO3沉淀的方法是 。
判断沉淀是否洗净的方法是 。
SO2、NO2、可吸人颗粒物是雾霾的主要组成。
(1)SO2可用氢氧化钠来吸收。现有0.4 molSO2,若用200 mL,3mol·L—1NaOH溶液将其完全吸收,生成物为 (填化学式)。经测定所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为 。
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为: 。
(3)氮氧化物和碳氧化物在催化剂作用下可发生反应:2CO+2NO N2+2CO2,在体积为0.5L的密闭容积中,加入0.40mol的CO和0.40 mol的NO,反应中N2的物质的量浓度的变化情况如图所示,从反应开始到平衡时,CO的平均反应速率υ(CO)= 。
N2+2CO2,在体积为0.5L的密闭容积中,加入0.40mol的CO和0.40 mol的NO,反应中N2的物质的量浓度的变化情况如图所示,从反应开始到平衡时,CO的平均反应速率υ(CO)= 。
(4)用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H>0。
CH3OCH3(g)+3H2O(g)△H>0。
合成二甲醚时,当氢气与二氧化碳的物质的量之比为4︰1,CO2的转化率随时间的变化关系如图所示。
①A点的逆反应速率υ逆(CO2) B点的正反应速率为υ正(CO2)(填“>”、“<”或“=")。
②氢气的平衡转化率为 。
(5)液氨作为一种潜在的清洁汽车燃料,它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
铝是一种高能量载体,是开发电池的理想电极材料。如图所示的室温铝二次电池,采用有机阳离子(EMIm)和AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4 AlMn2O4下列说法正确的是
AlMn2O4下列说法正确的是
| A.电池放电时,AlCl4-向Y极扩散 |
| B.电池放电时,X是正极 |
| C.电池充电时X极的反应为:4Al2Cl7-+3e-=Al+7AlCl4- |
| D.铝作为负极材料的比能量高于锂 |