氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图。下列有关氢氧燃料电池的说法不正确的是
A.由于A、B两电极没有活动性差别,不能构成原电池
B.A电极是负极,电极上发生氧化反应
C.产物为无污染的水,属于环境友好的绿色电池
D.外电路中电流由B电极通过导线流向A电极
近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法正确的是
| A.碳极发生的反应是:2H2O+O2+4e-=4OH- |
| B.有机电解质通过固体电解质可进入水溶液中 |
| C.理论上,外电路中每转移1mol电子,负极消耗的质量为7g |
| D.该电池如可以充电,充电时碳极接外加电源的负极,锂极接外加电池的正极 |
如将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为CH4 + 10OH--8e-="==" CO32-+ 7H2O 下列叙述正确的是
| A.通入甲烷的一极为正极 |
| B.通入氧气的一极发生氧化反应 |
| C.该电池总反应为CH4 +2 O2 + 2OH-="==" CO32-+ 3H2O |
| D.该电池在工作时,溶液中的阴离子向正极移动 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
| A.放电时负极反应为:3Zn-6e-+6OH-====3Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O FeO42- +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 |
| D.充电时阴极溶液的碱性减弱 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为。
下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
C.电池反应的化学方程式为: |
D.正极上发生的反应是: |
铅蓄电池在现代生活中有广泛应用,其电极材料是PB 和PBO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
| A.蓄电池放电时,电路中每转移2 mol电子,最多有1 molPBO2被还原 |
| B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
| C.电解后, C(Na2SO4)不变,且溶液中有晶体析出 |
| D.蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O |
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:
2AgCl+Mg===Mg2++2Ag+2Cl-。有关该电池的说法不正确的是
| A.Mg为电池的负极 | B.正极反应为:AgCl+e-===Ag+Cl- |
| C.不能被KCl 溶液激活 | D.可用于海上应急照明供电 |
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是
| A.a为电池的正极 |
| B.电池充电反应为LiMn2O4=Li1-xMn2O4+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
一种充电电池放电时的电极反应为H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-
当为电池充电时,与外电源正极连接的电极上发生的反应是
| A.H2O的还原 | B.NiO(OH)的还原 | C.H2的氧化 | D.Ni(OH)2的氧化 |
氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,其电极反应如下:负极:2H2 + 4OH- - 4e- = 4H2O 正极:O2 + 2H2O + 4e- = 4OH—,当得到1.8L饮用水时,电池内转移的电子数约为
| A.1.8mol | B.3.6mol | C.100mol | D.200mol |
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。充放电时的电池反应为:Li+LiMn2O4 Li2Mn2O4。下列说法正确的是
Li2Mn2O4。下列说法正确的是
| A.放电时,LiMn2O4发生氧化反应 |
| B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4 |
| C.充电时,LiMn2O4发生氧化反应 |
| D.充电时,阳极反应为:Li++e-==Li |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiO(OH)+2H2O 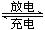 Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e-+OH-=NiO(OH)+H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为甲烷,然后将甲烷通入以KOH为电解质的燃料电池发电。电池负极反应为
| A.CH4-8e-+8OH-=CO2+6H2O | B.O2+4H++4e-=2H2O |
| C.CH4+10OH--8e-=CO32-+7H2O | D.O2+2H2O+4e-=4OH- |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH + 3O2 + 4OH—  2CO32— + 6H2O
2CO32— + 6H2O
则下列说法错误的
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:2CH3OH-12e-+16OH- = 2CO32— + 12H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
新型NaBH4—H2O2燃料电池(DBFC)的结构如图所示(已知.NaBH4中氢为-1价),有关该电池的说法不正确的是
A.放电过程中.Na+从A极区向B极区迁移
B.电极B材料中含MnO2层,MnO2起导电作用
C.在电池反应中,每消耗1 L 6 mol/LH2O2溶液,理论上流过电路中的电子为12 NA
D.电池负极区的电极反应为BH4—+8OH——8e—=BO2—+6H2O