下列表示化学反应的离子方程式,其中正确的是
A.NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH-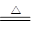 NH3↑+SO32-+2H2O NH3↑+SO32-+2H2O |
| B.向氯化铝溶液中加入过量氨水:Al3+ + 4NH3·H2O=AlO2- + 4NH4+ +2H2O |
| C.用盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: 2 MnO4-+6H++ 5H2O2=2Mn2++5 O2 ↑+ 8H2O |
D.用石墨电极电解饱和MgCl2溶液:2Cl-+2H2O H2↑+ Cl2↑ + 2OH- H2↑+ Cl2↑ + 2OH- |
下列离子方程式正确的是( )
| A.NaClO溶液中通入少量SO2:ClO-+SO2+H2O=2H++SO42-+Cl- |
| B.FeCl3溶液中通入过量H2S气体:2Fe3++3H2S=2FeS↓+S↓+6H+ |
| C.Na2CO3溶液中通入少量Cl2:2CO32-+Cl2+H2O=ClO-+Cl-+2HCO3- |
| D.NaHSO3溶液中通入少量Cl2:HSO3-+Cl2+H2O=3H++SO42-+2Cl- |
离子方程式2Ca2++3HCO3-+3OH-=2CaCO3↓+CO32-+3H2O可以表示( )
| A.Ca(HCO3)2与NaOH溶液反应 | B.Ba(HCO3)2与澄清石灰水反应 |
| C.Ca(HCO3)2与澄清石灰水反应 | D.NH4HCO3与澄清石灰水反应 |
能正确表示下列反应的离子方程式为
| A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S |
| B.NH4HCO3溶于过量的NaOH溶液中:HCO3−+OH−=CO32−+H2O |
| C.少量SO2通入苯酚钠溶液中:C6H5O−+SO2+H2O=C6H5OH+HSO3− |
| D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO−+CO2↑+H2O |
下列离子方程式的书写及评价均合理的是
| 选项 |
离子方程式 |
评价 |
| A |
将2 mol Cl2通入到含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 |
正确; Cl2过量,Fe2+、I-均被氧化 |
| B |
用Cu电极电解NaCl溶液阳极的电极反应式: 2Cl--2e-===Cl2↑ |
正确; Cl-优先于OH-放电 |
| C |
过量SO2通入到NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- |
正确; H2SO3的酸性强于HClO |
| D |
Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++2HCO3-+4OH-=== Mg(OH)2 ↓+2CO32-+2 H2O |
正确; Mg(OH)2比MgCO3更难溶 |
玻璃容器被下列物质沾污后,需要洗涤。如洗涤方法属于物理方法的,请写出所需试剂;洗涤原理属于化学反应的,写出有关反应的离子方程式;若无法用试剂使容器复原者,请说明原因。
(1)盛石灰水后的沾污:
(2)碘的沾污:
(3)硫的沾污:
(4)长期盛强碱溶液的试剂瓶变“毛”了。
(1)二氧化硅与碳高温下反应的化学方程式为
上述反应中生成的单质有什么用途: (写一条即可)。卞石是硅酸盐,不同类型的卞石中氧原子的物质的量分数相同,由钠卞石化学式NaAlSi3O8可推知钙卞石的化学式为 ,请将钠卞石的化学式改写成氧化物的形式:
(2)天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
COS Na2S溶液
Na2S溶液 H2 羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
H2 羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
有一未完成的离子方程式: +XO3-+6H+===3X2+3H2O,据此判断X元素的最高化合价为 ( )
+XO3-+6H+===3X2+3H2O,据此判断X元素的最高化合价为 ( )
| A.+7 | B.+6 | C.+5 | D.+1 |
现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
已知:①E、F两溶液呈碱性;G、M、N 溶液呈酸性。
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失。
③M溶液与另外四种溶液反应都能产生沉淀。
下列说法正确的是( )
A.N溶液与过量的F溶液反应的离子方程式为: Ba2+ + SO42- = BaSO4↓
B.E溶液与N溶液混合发生反应的离子方程式为:2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+ 3CO2↑
C.M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中
D.将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为
2H+ + CO32- = CO2↑+ H2O
离子方程式正确的是( )
| A.0.01mol NH4Al(SO4)2溶液与0.01mol·L-1Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
B.用惰性电极电解CuCl2溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| C.将标准状况下的11.2L氯气通入200mL2mol·L-1的FeBr2溶液中,离子反应方程式为: 4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- |
| D.铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+=Fe3++3NO2↑+3H2O |
Ⅰ有一份无色溶液,只可能有Na+、Cl-、H+、SO42-、CO32-、Cu2+、NO3-中的几种(忽略水电离产生的少量OH-)。取该溶液检测,发现溶液显强酸性。
(1)不需要进一步实验,可以判断,溶液中一定存在________,一定不存在__________。
(2)进一步测定,发现该溶液中c(H+)=0.1mol/L,取100mL该溶液,加入足量BaCl2,生成2.33g沉淀,过滤,滤液中加入足量AgNO3溶液,产生5.74g沉淀。100mL溶液中是否有Cl—______(填一定有、一定没有、可能有),100mL溶液中Na+的物质的量浓度至少为_______mol/L。
Ⅱ现有易溶于水的五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X__________,C__________,B__________
(2)完成A溶液与X气体反应的离子方程式:__________
(3)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为_____________。
(4)已知NaHCO3溶液呈碱性,B溶液与A溶液反应至恰好溶液呈中性,写出该过程的离子方程式_________
粗盐中含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)NaCl既属于_______(填酸、碱或盐),也属于______(填强电解质或弱电解质),该分类方法称为_______,NaCl溶液中共含有________种微粒(包含分子和离子)
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸.
其中,在步骤②中主要涉及的离子反应方程式是____________________________;步骤①和③能否交换顺序_______(填能或不能)。
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是___________。(NA表示阿伏加德罗常数)
| A.粗盐中Na+数目为aNA/58.5 | B.精盐中NaCl物质的量为b/58.5mol |
| C.粗盐中NaCl的质量分数为b/a×100% | D.粗盐中关于NaCl的量无法确定 |
(4)某已滤去泥沙的粗盐经检验不含Na2SO4。该粗盐溶于水配成100mL溶液,加入过量稀NaOH溶液后,过滤得到沉淀Mg(OH)25.8g,滤液中通入CO2,得到如下图(横坐标表示通 入CO2标准状况下的体积,纵坐标表示沉淀的物质的量),回答下列问题:
①b段表示的离子方程式为__________
②100mL溶液中Ca2+的物质的量与所加NaOH的物质的量之比为__________
③P点表示的CO2的体积为__________(标准状况下)。
下列解释事实的化学方程式或离子方程式不正确的是( )
| A.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O |
| B.自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶液的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 |
| C.在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 |
| D.在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4 |
下列指定反应的离子方程式不正确的是
| A.硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+=S↓+SO2↑+H2O |
| B.向CuSO4溶液中通入H2S气体:Cu2++S2-=CuS↓↑ |
| C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl- |
D.重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O 2H++2CrO42-(黄色) 2H++2CrO42-(黄色) |