过氧化钠和水反应的离子方程式是
| A.Na2O2 + 2H2O ===2Na+ + 2OH-+ H2↑ |
| B.2O22−+ 4H+===4OH-+ O2↑ |
| C.Na2O2 + 2H2O ===2Na+ + 2OH-+ O2↑ |
| D.2Na2O2 + 2H2O ===4Na+ + 4OH-+ O2↑ |
下列离子方程式书写正确的是( )
| A.氨气通入醋酸溶液中:CH3COOH+NH3=CH3COONH4 |
| B.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C.氢氧化钡和稀硫酸:Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O |
| D.氧化镁中加稀盐酸:2H++MgO=H2O+Mg2+ |
按要求用化学用语回答下列问题:
(1)除去混入Fe2O3粉末中少量Al2O3杂质的试剂是 ,
离子方程式为 。
(2)在呼吸面具中,Na2O2 起反应的化学方程式为 。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是___ _。(用化学方程式表示).
(4)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是_____ ____(写化学式).
某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质有__________。
下列离子方程式书写正确的是 ( )
| A.铝粉投入到NaOH溶液中:2Al+2OH- == 2AlO2-+H2↑ |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH-== Al(OH)3↓ |
C.三氯化铁溶液中加入铁粉: |
| D.FeCl2溶液跟Cl2反应:2Fe2++Cl2="=" 2Fe3++2Cl- |
下列离子方程式书写正确的是
①将金属Na投入水中:2Na+2H2O=2Na++2OH-+H2↑
②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
③碳酸氢钙溶液中滴加盐酸:HCO3-+H+=CO2↑+H2O
④碳酸钙中滴加盐酸:CO32--+2H+=CO2↑+H2O
| A.①③ | B.②④ | C.①②③ | D.①③④ |
有关物质的转化关系如下图所示(部分物质和条件已略去)。A、D是常见金属,B、C是它们的氧化物,B是红棕色固体,D是年产量最高的金属,I、J是氯碱工业的主要产品,H是一种常见强酸,可由氯碱工业的产品为原料制得。请回答下列问题:

(1) B的化学式为 。
(2) H的电子式为 。
(3) 写出E与I反应的离子方程式: 。
(4) 写出A与J反应的化学方程式: 。
下列离子方程式书写正确的是
A.惰性电极电解硫酸铜溶液:2Cu2+ + 2H2O 2Cu+ O2↑+4H+ 2Cu+ O2↑+4H+ |
B.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH- CH3COO-+NH4++3NH3+2Ag↓+H2O CH3COO-+NH4++3NH3+2Ag↓+H2O |
C.苯酚钠溶液中通入少量的CO2: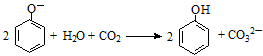 |
| D.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e-= 4OH- |
有NaHSO4、Ba(OH)2、NaHCO3三种溶液,已知其中两种溶液的物质的量浓度相同,且分别为另一种溶液的物质的量浓度的2倍;若先将 NaHSO4和NaHCO3溶液各100mL混合反应后,再加入Ba(OH)2溶液100mL,充分反应后,将生成的白色沉淀滤出,得300mL滤液,测得滤液中只含NaOH溶质,其物质的量的浓度为 0.9 mol·L-1(不考虑混合时引起的溶液体积的变化),试回答下列问题:
(1)写出Ba(OH)2溶液与过量NaHCO3溶液反应的离子方程式: ;
(2)写出NaHSO4溶液和NaHCO3溶液反应的离子方程式: ;
(3)通过分析,判断原Ba(OH)2、NaHSO4、NaHCO3三种溶液中哪两种溶液的物质的量浓度不可能相同?(填化学式)。
(4)题中NaHCO3溶液的浓度可能为 。
玻璃容器被下列物质沾污后,需要洗涤。如洗涤方法属于物理方法的,请写出所需试剂;洗涤原理属于化学反应的,写出有关反应的离子方程式;若无法用试剂使容器复原者,请说明原因。
(1)盛石灰水后的沾污:
(2)碘的沾污:
(3)硫的沾污:
(4)长期盛强碱溶液的试剂瓶变“毛”了。
下列反应的方程式正确的是
| A.浓盐酸与铁屑反应的离子方程式:2Fe + 6H+ = 2Fe3+ + 3H2↑ |
| B.钠与CuSO4溶液反应的离子方程式:2Na + Cu2+ =" Cu↓+" 2Na+ |
| C.NaHCO3溶液与NaOH反应的离子方程式:HCO3—+ OH—= H2O+ CO2↑ |
| D.将CO2通入饱和碳酸钠溶液直至过量的离子方程式: |
2Na+ + CO2 + CO32- + H2O = 2NaHCO3↓
下列离子方程式书写正确的是
A.Na2S溶液的水解:S2-+ 2H2O H2S + 2OH- H2S + 2OH- |
B.NaHCO3溶液的电离:HCO3-+ H2O H2 CO3+ OH- H2 CO3+ OH- |
C.NH4Cl溶液的水解:NH4+ + H2O NH3·H2O + H+ NH3·H2O + H+ |
| D.泡沫灭火器灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ |
金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
(1)工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为 。
(2)铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3+ + 3S2O82-+ 7H2O=Cr2O72-+ 6SO42-+ 14H+
②Cr2O72-+ 6I-+ 14H+=2Cr3+ + 3I2 + 7H2O
③I2 + 2S2O32-=2I-+ S4O62-
现有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3、Na2SO4现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀产生:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题:
(1)判断原白色粉末中肯定含有, ,可能含有 。
(2)写出上述实验中一定发生的有关反应的离子反应方程式: 。
解释下列事实的离子方程式不正确的是
| A.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=SiO32-+H2O |
| B.用大理石与稀盐酸制备CO2:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-=BaSO4↓ |
| D.Cu与浓H2SO4反应放出气体:Cu+2H+=Cu2++H2↑ |