(1)按要求写出下列反应的离子方程式:
① 少量二氧化碳通入澄清石灰水 。
② 硫酸氢钠与过量氢氧化钡溶液混合 。
③ 熔融状态下NaHSO4电离方程式 。
(2)①用双线桥表示下列氧化还原反应电子转移:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
②配平下面方程式:
KMnO4+ H2O2+ H2SO4 — K2SO4 + MnSO4 + O2↑+ H2O
从海水中提取一些重要的化工产品的工艺流程如图所示。

根据上述流程图回答下列问题:
(1)图中A的化学式为____________,在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为_____________________。
(2)海水淡化处理的方法有______________________________。(写出3种即可)
(3)过程⑤的化学方程式为_________________________。
(4)从B溶液制备B的无水晶体的“操作a”为_____________________。
(5)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式 ______________________________。
(6)过程②到过程④的变化为“Br-→Br2→Br-→Br2”,其目的是_____ 。
根据下图转化关系以及实验现象填写空白。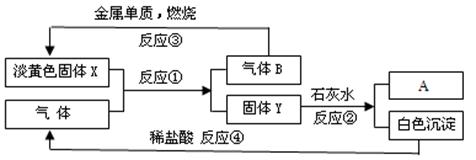
(1)固体X是_______,产物A是_______(填写化学式)。
(2)反应①的化学方程式是 ____________________。
(3)反应④的离子方程式是 _____________________________。
下列各物质转化关系如图所示,A是一种高熔点固体,D是一种红棕色固体。
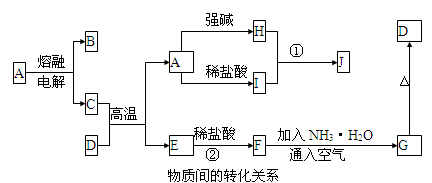
根据上述一系列关系回答:
(1)填写物质的化学式:B , G 。
(2)写出D物质中金属元素基态原子的核外电子排布图 。
(3)写出下列反应的离子方程式:
①H溶液和I溶液混合生成J___________ 。
②E和盐酸反应 。
(4)在电解熔融状态A的过程中,当电路中通过1mol电子时,阳极上产生的气体体积为 L。(标准状况下)
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32ˉ、SO42ˉ、SiO32ˉ、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。

请回答下列问题:
(1)沉淀K为 ,由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是__________。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与02的物质的量之比为______________。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMn04溶液
⑥氯水和KSCN的混合溶液
根据如图所示的化学反应框图解题。
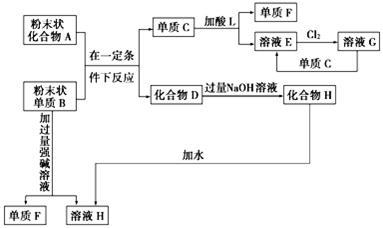
(1)单质F是 ,溶液H中所含的主要离子是 。
(2)写出下列反应的化学方程式:
C+L→F+E: ,
B→F+H: 。
(3)写出下列反应的离子方程式:
E+Cl2→G: ,
D→H: 。
下图中A~H均为中学化学中常见的物质,它们之间有如下转化关系。其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应。(反应过程中生成的水及其他产物已略去)

请回答以下问题:
(1)A是(填名称) ; H是(填化学式) 。
(2)请写出反应C→D的化学方程式,并用单线桥或双线桥法标明该反应中电子转移的方向和数 目: 。
(3)Na2O2也可以生成D,写出其反应的化学方式: 。
(4)写出E转化为G的离子方程式: 。
(5)写出D转化为F的化学方程式: 。
下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液。

请回答下列问题:
(1)B的化学式为 。
(2)反应②在工业上通常称之为 工业。
(3)写出反应③的离子方程式 。
(4)写出反应④的化学方程式 。
在如图所示的一些常见单质,化合物等物质之间的转化关系中(有些反应过程中的水,部分产物和反应条件未全部列出),已知反应①是氯碱工业的最基础的反应,A、B、F、H、J的焰色反应均为黄色,热的F溶液可以去除物品表面的油污,I为地壳中含量最多的金属元素的单质,L是典型的两性氧化物,在常温常压下C、D、G均为气体,D呈黄绿色,G是形成温室效应的主要气体.
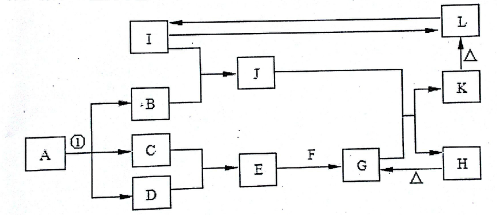
(1)反应①进行的条件为 .
(2)化合物F的化学式为 .
(3)I与氧化铁反应的化学方程式为 .
(4)J的水溶液与G反应生成K和H的离子方程式为 .
下列框图所示的转化关系中,甲为生活中常见的金属单质,乙、丙、丁为气体单质,D为家庭中常用物质(部分反应物和生成物及溶剂水已略去).
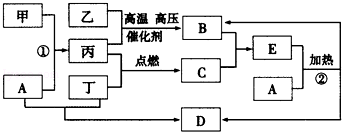
请回答:
(1)E的化学式为 ;甲的原子结构示意图为 ;
(2)反应①的离子方程式为 ;反应②的化学方程式为 ;
(3)实验室制取并收集B的操作中,用 法收集B,验证B已收集满的方法是 (限答一种).
(4)实验室制备丁的方程式为 ,工业上输送丁的管道出现气体泄漏,如何查漏(用方程式表示) .
(根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
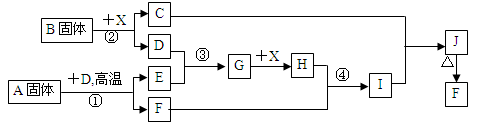
(1)A的化学式为 ; F的化学式为 ;
(2)反应 ③的化学方程式: ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
。
有关物质的转化关系如下图所示(部分物质和条件已略去)。A、D是常见金属,B、C是它们的氧化物,B是红棕色固体,D是年产量最高的金属,I、J是氯碱工业的主要产品,H是一种常见强酸,可由氯碱工业的产品为原料制得。请回答下列问题:

(1) B的化学式为 。
(2) H的电子式为 。
(3) 写出E与I反应的离子方程式: 。
(4) 写出A与J反应的化学方程式: 。
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。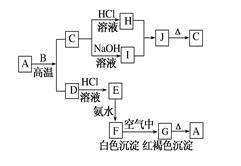
(1)写出下列物质的化学式:
A:_______,E: ______,J:_______,G:_______。
(2)按要求写方程式:
A与B在高温条件下生成C和D的化学方程式:______________________;
F在空气中转化为G的化学方程式:________________________________;
C转化为I的离子方程式:________________________________________。
已知A、B、C、D四种强电解质溶液,分别含有下列阴阳离子中的各一种,且互不重复:Ba2+、H+、Na+、NH4+、CO32﹣、NO3﹣、SO42﹣、OH﹣.已知:①A和B反应生成的气体能被D吸收,而A和D反应生成的气体能被B吸收;②向A或D中滴入C,均有白色沉淀产生.另有晶体E的摩尔质量为474g/mol,可用于自来水的净水剂.试判断:
(1)晶体E的名称为 ,用离子方程式和必要的文字说明E可用作净水剂的原理 .
(2)写出A、B、C的化学式:A ,B ,C .
(3)写出A与D反应的离子方程式 .
(4)将200mL0.5mol/L的B溶液加入到150mL0.2mol/L的E溶液中,最终生成的白色沉淀质量为 g.