研究碳及其化合物有重要意义。
(1)科学家用CO2和H2生产甲醇做燃料。
已知:甲醇的燃烧热ΔH= -726.5kJ/mol;氢气的燃烧热ΔH= -285.8kJ/mol;
则常温常压下,CO2(g)和H2(g)反应生成CH3OH(l)的热化学方程式 。
(2)460℃时,在4L密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2和CH3OH(g)的物质的量随时间的变化关系如图所示。
①从反应开始到3min时,H2O(g)的平均反应速率 ,
②下列措施中既能加快反应速率又能使H2的转化率增大的是 ,
| A.使用更有效的催化剂 |
| B.在原容器中再充入1mol CO2 |
| C.在原容器中再充入1mol He |
| D.缩小容器的体积 |
E、将甲醇及时分离出来
③若该反应的焓变为ΔH,则下列示意图正确且能说明反应达到平衡状态的是________。
④该条件下,此反应的化学平衡常数为 。
(3)科学家研究发现,还可以用电催化法将CO2还原为碳氢化合物。原理如下图所示(电解质溶液是一种钾盐)。若CxHy为C2H4,则该原理的总反应式为为: 。
(4)已知
| 化学式 |
电离平衡常数 |
| HCN |
K=4.9×10-10 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=_________。
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:________________。
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_________m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是_____________________。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
| A.CuO | B.Al(OH)3 | C.NaOH | D.NaHCO3 |
若调节后溶液的pH偏离3.5,可能带来的后果是__________________________。
(15分)铝及其化合物用途广泛
(1)铝元素的离子结构示意图为
(2)下列实验能说明Al的金属性(原子失电子能力)小于Na的是 (填序号)。
a.分别将Na和Al同时放人冷水中
b.测定等物质的量的Na和A1与酸反应生成H2的体积
c.向Al(OH)3悬浊液中加人足量NaOH溶液
d.用pH计测量NaCl溶液与AlC13溶液的pH
(3)工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,每生产1吨Al,阳极大约会损失0.6吨的石墨,则石墨被氧化为 (填化学式)。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为____
(5)室温下,往0.2 mol·L-1 Al2 ( SO4)3溶液中逐滴加人1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图所示
①a点溶液呈酸性的原因是(用离子方程式表示)_______
②c→d时,A1元素的主要存在形式是 (填化学式)
③根据图中数据计算,A1(OH)3的KSP ≈ 。
元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的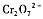 ,处理该废水常用直接沉淀法或还原沉淀法。
,处理该废水常用直接沉淀法或还原沉淀法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡: 。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 。
。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 。
Ⅱ,还原沉淀法
(2)下列溶液中可以代替上述流程中 溶液的是 (填选项序号)。
溶液的是 (填选项序号)。
| A.FeSO4溶液 | B.浓H2SO4溶液 |
| C.酸性KMnO4溶液 | D.Na2SO3溶液 |
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为 。
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示: 。
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
①阳离子交换树脂的原材料质疑是聚苯乙烯,其单体为苯乙烯(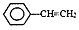 ),聚苯乙烯的化学式为 。
),聚苯乙烯的化学式为 。
②某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 。
实验题
(1)为准确测定中和热,除了提供的酸和碱溶液的浓度与体积必须准确外,在实验过程中的另外两个重要措施是: 、
(2)在草酸溶液中加入酸性高锰酸钾溶液,发生如下反应。请配平:
该反应开始时速率较慢,但一段时间后,紫色突然褪去,其主要原因是: 。
(3)人们常常根据反应的特征现象来判断反应进行的快慢。对于下列反应:Na2S2O3 + H2SO4 =Na2SO4+S+SO2+H2O 通常测定在一定条件下单位时间内出现 (明显) 现象来比较该反应进行的快慢。为增大上述反应的速率,可采取的不同措施有: , 。
(本小题满分14分)
I.H2A在水中存在以下平衡:H2A 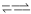 H++HA-,HA
H++HA-,HA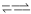 H++A2- 。
H++A2- 。
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为_____________。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是_____________。
A.c(Na+ )>c(K+ ) B.c(H +)•c(OH )=1×10-14
C.c(Na+ )=c(K+ ) D.c(Na+ )+c(K+ )=c(HA )+c(A2- )
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) 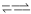 Ca2+ (aq)+A2- (aq)
Ca2+ (aq)+A2- (aq)
滴加少量Na2A固体, c(Ca2+ )_____________(填“增大”、“减小”或“不变”),原因是______________。
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L 的Cr2O7。为使废水能达标排放,作如下处理:
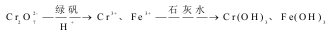
(1)该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_____________。
(2)欲使25 L该废水中Cr2O7转化为Cr3+,理论上需要加入_____________g FeSO4·7H2O。
(3)若处理后的废水中残留的 c(Fe )=1×10-13mol/L ,则残留的 Cr3+的浓度为____________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,根据要求解决下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
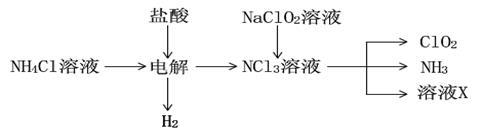
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)为了测定混合气体中ClO2的含量,我们通常用酸化的KI溶液与之反应。
①请写出ClO2与碘化钾反应的离子方程式为 。
②如果反应过程中共消耗了 0.04 mol的KI,则此混合气体中ClO2的质量为________克。
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色迅速变为灰绿色,最终转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
(1)则各物质的化学式为:A 、B 、C 、D 。
(2)现象②中所发生的反应的化学方程式为:
、 。
(3)现象③中所发生反应的离子方程式为:
、 。
钨是我国丰产元素,也是熔点最高的金属,被誉为“光明使者”。用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如下。已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物。请回答下列有关问题:
(1)上述流程中通入空气的目的是 ;
(2)滤渣A与硫酸反应的离子方程式为 ;
(3)实验室用锌锰碱性电池作做电源模拟氯碱工业的装置如下图:
已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,则锌锰碱性电池的锌电极应与装置中电极 (填“A”或“B”)相接,气体Y为气体出口 (填“A”或“B”)出来的气体,为提高生产效率,电解开始时,从进料口B加入的物质为 ,写出锌锰碱性电池正极反应式 ;
(4)已知:单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因 ;
(5)将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
试用化学方法除去下列物质中混有的少量杂质,要求除杂试剂均过量,若为溶液中的离子反应请写出其离子方程式,否则写化学方程式。并写出相应的分离方法。
(1)除去FeCl2溶液中混有的少量FeCl3;方程式: ______________ 。分离方法:______
(2)除去CO2气体中混有的少量HCl;方程式:_______________。分离方法:______
(3)除去NaCl溶液中混有的少量NaBr;方程式:__________________。分离方法:______
(12分)高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下:
(1)由粗盐(含Ca2+、Mg2+、SO42-、Br-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。Na2CO3的作用是____________;除去盐水中的Br-可以节省电解过程中的电能,其原因是________________。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有______________(填化学式)。“电解Ⅱ”的化学方程式为_____________________。
(3)“除杂”的目的是除去少量的NaClO3杂质,该反应的离子方程式为_______________________。“气流干燥”时,温度控制在80~100 ℃的原因是__________________。
现有A、B、C、D、E五种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元素 |
性质 |
| A |
该元素的最外层电子数是次外层电子数的2倍 |
| B |
该元素形成的最简单氢化物常用作制冷剂 |
| C |
该元素是电负性最大的元素 |
| D |
该元素的一种氧化物具有磁性 |
| E |
E+原子核外有3层电子且各层均处于全满状态 |
根据以上信息,回答下列问题:
(1)A、B、C三种元素的第一电离能由大到小的顺序是 (用元素符号表示);E基态原子价电子电子排布式是__________。
(2)BC3分子的空间构型为 ,B和C两元素的氢化物的沸点相比较,较高的是 (写分子式)
(3)一定条件下,A元素可形成多种晶体。图1是其中某种晶体的一个晶胞,该晶胞中含有______个A原子。

(4)图2为D元素的单质形成的某种晶体的晶胞结构,已知该晶体的密度为a g/cm3,NA为阿伏加德罗常数的值,则该晶胞的体积为_________cm3。
(5)向E的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液。写出此沉淀溶解的离子方程式:_ ___。
【化学—选修2化学与技术】聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:

(1)水是生命之源,水质优劣直接影响人体健康. 天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是 。水的净化与软化的区别是 。
(2)“碱溶”时,发生反应的化学方程式为 。“滤渣Ⅰ”成分是_________。
(3)“酸溶Ⅱ”时,可以产生Fe2+的反应的离子方程式为 。
(4)“氧化”时应控制在比较低的温度下进行,原因是 。
(5)“氧化”时若用ClO2代替,发生反应的离子方程式是 。
(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的 I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是用离子方程式解释 .
(3)在100mLFeBr2溶液中通入标况下2.24LCl2, 溶液溶液中有1/4的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式____ 。向反应后的溶液中通入过量CO2,反应的离子方程式为 _______________________________。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式 ,反应中生成0.2mol HNO3,转移的电子数目为 。②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是 。
短周期元素X、Y、Z、Q在元素周期表中的相对位置如下图,地壳中含量最高的元素已包含其中。
| |
|
Y |
|
Q |
|
| X |
|
|
|
|
Z |
回答下列问题:
(1)Q在元素周期表中的位置是 。X离子的结构示意图为 。
(2)下列选项中,能证明元素非金属性Z强于Y的是 。
A.反应中,Y原子得到的电子数比Z原子得到的电子数多
B.最高正价,Z比Y的高
C.最高价氧化物的水化物酸性:Z>Y
(3)ZQ2是国际公认高效安全杀菌消毒剂,已知ZQ2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ZQ2被还原为Z—,该反应的离子方程式为 。
(4)H元素与Y形成的化合物中二者的质量之比是1:3,已知常温下4g该化合物完全燃烧并恢复到原来温度时放出222.6kJ热量,则表示该化合物燃烧热的热化学方程式为_________________。
(5)表中X的最高价氧化物对应水化物的化学式为X(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,则其饱和溶液中的pH =_____(已知:T℃,Ksp[Y(OH) n]=4.0×l0-12;lg5=0.7)。