福建省福州市高三3月月考理综化学试卷
从化学看生活,你认为合理的说法是
| A.塑料制品长期不使用也会老化 |
| B.碱性食品是健康食品 |
| C.燃烧产生烧蕉羽毛味的布料是纯羊毛制品 |
| D.烧酒中最多的分子是乙醇分子 |
下列关于乙酸说法错误的是
| A.乙酸与甲酸甲酯(HCOOCH3)互为同分异构体 |
| B.乙酸与乙醇都能与Na反应,生产H2 |
| C.加入生石灰再蒸馏可以除去冰醋酸中少量的水 |
| D.饱和Na2CO3溶液可除去乙酸乙酯中少量的乙酸 |
四种短周期元素在周期表中的相对位置如下图所示,其中Y为空气中含量最大的元素。下列叙述合理的是
| A.元素W位于第三周期第ⅦA族 |
| B.Y、Z都是植物必需的元素 |
| C.原子半径:W>Z>Y>X |
| D.X氧化物的大量排放导致化学烟雾 |
常温下,0.1 mol·L-1CH3COONa溶液pH =a,则下列说法正确的是
| A.CH3COOH在常温下Ka数值约为l×101-2a |
| B.约有1.0×l0a-14 mol·L-1的水发生电离 |
| C.加热后溶液pH <a |
| D.加少量水后,溶液pH >a |
某同学为研究电化学原理,使用KC1盐桥设计如图所示实验装置。下列分析不合理的是
| A.闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 |
B.无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是 |
| C.闭合K,断开K2,电流从石墨电极经过K.流向铁电极 |
| D.闭合K,断开K2,左侧烧杯中的溶液pH将逐渐降低 |
恒温条件下,往容积为2L的密闭容器内加入0.4 mol的N2和一定量的H2,在一定条件下发如下反应: ,反应中NH3物质的量变化情况如下图:下列说法合理的是
,反应中NH3物质的量变化情况如下图:下列说法合理的是
A.反应前l0min反应速率 |
| B.N2平衡转化率为50% |
| C.若平衡时气体总压强为开始时的80%,则12min时氨气的体积分数为25% |
| D.其它条件不变,若改用5L容器达到平衡需 |
要的时间将小于l0min
(1 5分)X、Y为短周期主族元素,X的主族序数是周期序数的两倍,Y的原子序数比X大l.
I.若X.Y是组成蛋白质的基础元素。
(1)X和Y的气态氢化物中热稳定性较强的是 (填写化学式)。
(2)蛋白质和葡萄糖都是人体需要的有机物,检测葡萄糖存在的实验操作与现象是 。
(3)已知298K时,X和XO的标准燃烧热分别为 该温度下X转化为XO的热化学方程式为 。
该温度下X转化为XO的热化学方程式为 。
Ⅱ.若火山口附近常存在黄色的X单质。
(4)X2—的结构示意图为 。
(5)工业上常用含X元素的矿石制取H2XO4,某工厂利用100吨含X 40%的矿石为原料,制得98%H2XO4溶液100吨,则H2XO4的产率为 。
(6)工业中常用Y2与石灰浆反应制取漂白粉,该反应的化学方程式为 。
元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的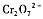 ,处理该废水常用直接沉淀法或还原沉淀法。
,处理该废水常用直接沉淀法或还原沉淀法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡: 。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 。
。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 。
Ⅱ,还原沉淀法
(2)下列溶液中可以代替上述流程中 溶液的是 (填选项序号)。
溶液的是 (填选项序号)。
| A.FeSO4溶液 | B.浓H2SO4溶液 |
| C.酸性KMnO4溶液 | D.Na2SO3溶液 |
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为 。
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示: 。
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
①阳离子交换树脂的原材料质疑是聚苯乙烯,其单体为苯乙烯(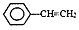 ),聚苯乙烯的化学式为 。
),聚苯乙烯的化学式为 。
②某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 。
(1 5分)无水氯化铝是有机化工常用的催化剂,氯化铝178℃时升华,极易潮解,遇水发热并产生白色烟雾。氯化铝还易溶于乙醇、氯仿和四氯化碳。
实验室可用反应 制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
(1)A烧瓶中发生反应的化学方程式:
(2)以下三步操作的先后顺序为 (填序号)。
①点燃A处酒精灯
②点燃C处酒精灯
③滴加A处浓硫酸
(3)D中干燥管内碱石灰的作用是 。
(4)下列有关AICl3的说法合理的是 (填序号)。
①AlCl3水溶液能导电
②熔融态AlCl3能导电
③镁条能置换出AlCl3溶液中的Al
(5)实验室也可通过反应 制备无水氯化铝,此法若还利用上述装置,在A烧瓶中增用Mn02。固体之外,还必须对装置进行的改动是 。
制备无水氯化铝,此法若还利用上述装置,在A烧瓶中增用Mn02。固体之外,还必须对装置进行的改动是 。
(6)指出该实验装置可能存在的一种安全隐患: 。
[化学一物质结构与性质)
I.镁条在空气中燃烧主要发生以下三个反应:
2Mg+O2 2MgO 3Mg+N2
2MgO 3Mg+N2 2Mg3N2 2Mg+CO2
2Mg3N2 2Mg+CO2 2MgO+C
2MgO+C
(1)基态氮原子核外电子的轨道表示式为 .
(2)上述三个反应中所涉及的非金属元素.的第一电离能由大到小的顺序为 。
(3)MgO的晶体结构模型如图所示,若MgO晶体密度为ρg/cm3,图示中O2-与O2-的核间距a= .
Ⅱ.Mg3N2溶于水发生反应:Mg3N2+8H2O=3Mg(OH)2↓+2NH3·H2O
(4)氨水中各种微粒间不涉及的作用力是 (填选项序号)。
A.离子键
B.共价键
C.配位键
D.金属键
E.氢键
F.范德华力
(5)在一定条件下将NH气与CO2混合可制得尿素[CO(NH2)2],尿素分子中 键的数目为 。
键的数目为 。
(6)向硫酸铜溶液中逐渐通入过量氨气,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。关于该晶体下列说法中正确的是 。
A.加入乙醇的目的是降低溶剂的极性,促使[Cn(NH3)4]SO4晶体析出
B.该配合物晶体中,N是配位原子,NH3为三角锥型,配位数是4
C.配离子内N原子排列成为平面正方形,可见Cu2+是sp3杂化
D.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
[化学一有机化学基础)芳香族化合物水杨酸、冬青油,、阿司匹林都是常用西药。它们的结构简式如下表:
(1)水杨酸分子中式量较大的含氧官能团名称是 。
(2)水杨酸在浓硫酸催化作用下与乙酸酐(CH3C0)20反应生成阿司匹林,反应的化学方程 。
(3)水杨酸在一定条件下可以聚合成高分子化合物聚水杨酸,聚水杨酸的结构简式为: 。
(4)写出冬青油的一种同分异构体结构简式:异构体符合以下条件:
①芳香族化合物;
②苯环上一个氢原子被氯取代,有两种可能的产物;
③在足量氢氧化钠溶液中充分反应消耗等物质的量氢氧化钠。
(5)效更佳的长效缓释阿司匹林( )在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为 ,反应类型为 。
)在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为 ,反应类型为 。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号