福建省厦门市普通高中高三质量检查理综化学试卷
化学家及其突出贡献为: ①波义耳(化学元素概念);②道尔顿(原子学说);③门捷列夫(元素周期律);④玻尔(玻尔原子模型)。这些突出贡献提出的年代顺序是
| A.①②③④ | B.②④①③ | C.③①④② | D.③④①② |
下列说法正确的是
A.乙醇和二氯甲烷都存在同分异构体
B油脂在碱性条件下才能水解
C.制聚乙烯塑料的反应属于取代反应
D.高温消毒是利用蛋白质变性的原理
下列关于实验的说法正确的是
| A.将二氧化碳通人硅酸钠溶液以证明碳酸的酸性比硅酸强 |
| B.上图装置中,导管不能伸人液面的原因是产物易溶于水 |
| C.用碱石灰可干燥氯气 |
| D.用普通玻璃棒蘸取溶液做焰色反应以证明溶液含有Na十 |
甲、乙、丙是中学化学常见物质,一定条件下能发生转化:甲+强酸→乙十丙十H2O ,其中乙为盐,丙为气体。下列说法正确的是
| A.甲一定是金属单质 | B.甲与乙一定含有同种元素 |
| C.丙一定是氧化物 | D.该反应一定是氧化还原反应 |
第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010 mol·L-1的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
| A.气态氢化物的稳定性:Z>W>Y |
| B.简单离子半径:Z<W |
| C.Y元素存在同素异形体 |
| D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有:
①CN- —2e- +2OH- ═CNO- +H2O
②2Cl- 一2e══Cl2 ↑
③3Cl2 +2CNO- +8OH-═N2 +6Cl-十2CO32-+4H2O
下列说法正确的是
| A.铁电极上发生的反应为Fe一2e一═Fe2+ |
| B.通电过程中溶液pH不断增大 |
| C.为了使电解池连续工作,需要不断补充NaCl |
| D.除去1 mol CN-,外电路至少需转移5 mol电子 |
在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)十CO2(g)≒CH3OH(g)+H2O(g)反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示下列说法错误的是
| A.P1> P2> P3>P4 |
| B.甲醇的物质的量分数越高,反应的平衡常数越大 |
| C.若T1> T2> T3>T4,则该反应为放热反应 |
| D.T4、P4、时,H2的平衡转化率为60% |
(15分)铝及其化合物用途广泛
(1)铝元素的离子结构示意图为
(2)下列实验能说明Al的金属性(原子失电子能力)小于Na的是 (填序号)。
a.分别将Na和Al同时放人冷水中
b.测定等物质的量的Na和A1与酸反应生成H2的体积
c.向Al(OH)3悬浊液中加人足量NaOH溶液
d.用pH计测量NaCl溶液与AlC13溶液的pH
(3)工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,每生产1吨Al,阳极大约会损失0.6吨的石墨,则石墨被氧化为 (填化学式)。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为____
(5)室温下,往0.2 mol·L-1 Al2 ( SO4)3溶液中逐滴加人1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图所示
①a点溶液呈酸性的原因是(用离子方程式表示)_______
②c→d时,A1元素的主要存在形式是 (填化学式)
③根据图中数据计算,A1(OH)3的KSP ≈ 。
(15分)铜及其化合物与生产、生活关系密切。
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是 (填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,
正极的电极反应式为
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如下: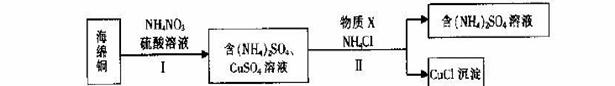
①步骤I中,反应温度不宜过高的原因是 。
②步骤I中,0.5 mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为 。
③步骤II中,物质X可选用的物质是 。(填序号)。
a.Cu b.C12 c.H2O2 d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是 _。
⑤步骤II中当NH4 Cl加到一定的量时,生成CuCl 会部分溶解生成CuCl2-在一定温度下建立两个平衡:
Cu Cl(s) 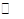 Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu Cl(s) + Cl一(a q)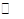 CuCl2(a q) K=0.35
CuCl2(a q) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2]-的关系曲线(要求至少标出坐标点)
(15分)过硫酸钠( Na2S2O8)是一种重要化工原料。某研究小组进行如下实验
实验一 过硫酸钠的制取
采用下图装置制取Na2S2O8。
装置I中:主反应:(NH4)2S2O8 +2NaOH Na2S2O8+2NH3↑+2H2o
Na2S2O8+2NH3↑+2H2o
副反应:①2NH3+3Na2S2O8十 6NaOH===6Na2SO4 +6H2o十N2
6NaOH===6Na2SO4 +6H2o十N2
②3Na2S2O8 +3H2O+3Na2SO4+3H2SO4 +O3 ↑
(1)装置Ⅱ的作用是 。
(2)装置I还需补充的实验仪器或装置有_ (填序号)。
a.温度计 b.酒精灯 c.水浴 d.洗气瓶
(3)装置I发生反应的同时需要持续通入氮气的目的是
实验二过硫酸钠的性质实验
(4)为研究Na2S2O8溶解度随温度变化情况,实验过程需要测定的数据是 。
(5)Na2S2O8溶液与铜反应时先慢后快,除反应放热这一因素外,有人认为还有一种可能是反应生成的Cu2+对后续反应起催化作用,能检验该说法是否正确的实验方案为 。
实验三过硫酸钠的应用研究
(6)为检验用Na2S2O8溶液吸收NO的可行性,某同学设计下图所示实验(已知NO不溶于NaOH溶液)。实验步骤如下:
i.检查装置气密性,并按下图加人试剂;
ii.打开a和d,通人足量N2,关闭d;
iii.往装置中通人适量NO,关闭a;
iv.....
①步骤iv中,对分液漏斗的操作是 _。
②能证明该方案可行的实验现象是 _。
选考〔化学—物质结构与性质](13分)
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,
反应原理为: 2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的核外电子排布式为 _
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2.S2O8的结构如图。
①H2.S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4 -,S2O82- 断裂的共价键类型及其数目为 。
(4)一定条件下,水分子间可通过O一H...O氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体
①下图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 ;
②实验测得冰中氢键的作用能为18.8目kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
选考[化学—有机化学基础](13分)
(1)可鉴别风信子醛和突厥酮的试剂是 。
(2)下列关于风信子醛和突厥酮的说法中正确的是 (填序号)。
a.都属于芳香族化合物 b.都能使酸性高锰酸钾溶液褪色
c.突厥酮的分子式为C13H20O d风信子醛不能发生加成反应
(3)突厥酮与嗅水反应的化学方程式为 。
(4)芳香烃A发生如下反应生成F:
F与冬青油互为同分异构体。请回答:
①若A的分子式为C10 H14,则能实现上述转化的A的同分异构体有 种
②C→D的反应类型为 。
③设汁C→D和E→F步骤的目的为 。
④F生成高聚物的化学方程式为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号