某溶液含Cl-、SO42-、CO32-三种阴离子,欲依次检验出此三种阴离子且只取用一次该溶液,则:
(1)最先检出的离子是 ,需加入稍过量的试剂是 (写化学式);
(2)最后检出的离子是 ,反应的离子方程式为 。
(本题共16分)已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2的酸性溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出Bi在周期表中的位置 ;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(3)实验④中的现象为: ;
(4)实验②反应的离子方程式是: ;
(5)实验③反应的离子方程式是:_ 。
氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:
2KMnO4+ 16HBr = 5Br2+ 2MnBr2+ 2KBr+ 8H2O
①其中还原剂为 ,还原产物为
②若有0.8 mol还原剂被氧化,则转移电子的物质的量是
(2)双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN,其中N为﹣3价),化学方程式为:KCN+H2O2+H2O═KHCO3+A↑(已配平)
①生成物A的化学式为
②用双线桥法表示该反应中电子转移的方向和数目:
(3)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
NaClO+ NH3·H2O  N2H4 + NaCl+ H2O
N2H4 + NaCl+ H2O
①请配平上述化学方程式
②NH3·H2O在上述反应中显示出来的性质是
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(4)人体内所含铁元素以Fe2+和Fe3+的形式存在市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为 ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式
(每空1分,共11分)写出有关离子方程式
(1)Na2SO4溶液中滴加Ba(OH)2:
(2)H2S的电离方程:
(3)NH4Cl溶液显 性:
(4)纯碱溶液显 性:
(5)将FeCl3饱和溶液滴入沸水中:
(6)用明矾净水:
(7)在配制AlCl3溶液时,为了防止发生水解,可以加入少量的 ;在配制FeSO4溶液时,为了防止溶液变质,可以加入少量的 和 。
(8分)某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
是常见的六种元素。
(1)位于元素周期表第周期第族;
的基态原子核外有个未成对电子;
的基态原子核外电子排布式为。
(2)用">"或"<"填空:
| 第一电离能 |
离子半径 |
熔点 |
酸性 |
(3)与
反应生成
和一种黑色固体。在25 ℃、101
下,已知该反应每消耗1
,放热44.4
,该反应的热化学方程式是。
(4)是常用于水的净化,工业上可用
氧化
溶液制取
。写出该反应的离子方程式,并标出电子转移的方向和数目。
按要求填空
Ⅰ除去括号中的杂质,写出所加试剂及反应的离子方程式
(1)Na2SO4(Na2CO3)试剂 ,离子方程式 。
(2)KCl(K2SO4)试剂 ,离子方程式 。
Ⅱ将正确答案填写在横线上
人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生________反应,说明亚硝酸钠具有________性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有________性。
工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图所示:
试根据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是__________。
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式__________,制备中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?(已知Cu2++Cu+2Cl-═2CuCl↓) __________。
(3)还原过程中加入少量盐酸的作用是__________,加入NaCl且过量的原因是__________。
(4)合成结束后所得产品用酒精淋洗的目的是__________。
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式__________。
烟气中主要污染物为SO2、NO、NO2,可用如下工艺进行脱硫脱硝及产物回收。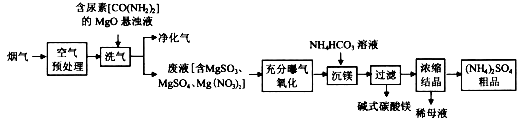
(1)空气预处理过程中,发生主要反应的化学方程式为____________________________。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体是_________________(填化学式)。
(3)充分曝气氧化过程中,发生反应的化学方程式为___________________。
(4)完成沉镁过程中生成碱式碳酸镁[MgCO3∙Mg(OH)2]的离子方程式
______Mg2++______= MgCO3∙Mg(OH)2↓+______CO2↑+______H2O
(5)(NH4)2SO4粗品中含有的主要杂质为__________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为________________。
①HCl、②过氧化钠、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是 (填序号,下同);上述四种物质加入紫色石蕊溶液中,溶液变红的是 。
(2)写出HCl的电离方程式 。
(3)写出过氧化钠与水反应的化学方程式___________________________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________。
(5)写出二氧化硅与氢氧化钠溶液反应的化学方程式_______________________。
在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g) Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。

①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为: 。
④原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。

①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。

①阳极的电极反应式为
②简述浓缩室中得到浓乳酸的原理:
③电解过程中,采取一定措施可控制阳极室pH约为6-8,此时进入浓缩室的OH-可忽略不计。
400mL 10 g•L-1乳酸溶液通电一段时间后,浓度上升为145 g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g• mol-1)
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和SiO2等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:

(1)实验室实现“操作I”所用的玻璃仪器有玻璃棒、 和烧杯;
(2)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 ,检验“酸溶”后的溶液中含有Fe2+的试剂及现象是 ;
(3)“操作Ⅲ”系列操作名称依次为 、冷却结晶、过滤和洗涤。洗涤沉淀的方法是 ;
(4)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式: 。
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右(写出最佳答案)

(1)沉淀1的化学式是 ,试剂C的名称是 ,分离出沉淀2的操作名称是 ;
(2)写出混合液+A的离子方程式
生成沉淀2的离子方程式
A~G各物质间的关系如图,其中B、D为气态单质。
请回答下列问题:
(1)物质C、E分别为 、 。(填名称)
(2)反应①可选用不同的A进行,若反应在常温下进行,其化学方程式为 。
(3)反应②的离子方程式为 。
(4)新配制的F溶液应加入________以防止其转化为G。请设计实验检验F、G的混合溶液中F的金属阳离子。(写出试剂、操作、现象、结论) 。