(1)5.3gNa2CO3的物质的量是 ,约含有Na+ 个。
(2)同温同压下的氮气和氢气,若体积相同时,两种气体的质量比 ,其密度比为 ;若质量相等时,两种气体的体积比为 。
(3)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成AgCl沉淀的质量之比为________。
(4)相同物质的量浓度的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,当生成的AgCl质量相同时,消耗的三种溶液的体积比为________。
(5)相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3∶2∶1时,三种溶液的体积比为________。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
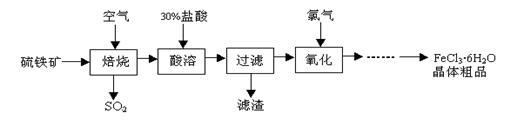
请回答下列问题:
(1)硫铁矿“焙烧”中反应的化学方程式为3FeS2 +8O2 + 6SO2,则 中的化学式为 ,反应中化合价升高的元素有 。
+ 6SO2,则 中的化学式为 ,反应中化合价升高的元素有 。
(2)“酸溶”中反应的化学方程式为 。
(3)“过滤”后滤液中金属阳离子有 。
(4)“氧化”中反应的离子方程式为 。
(5)该工艺流程中产生的SO2会污染空气,常用烧碱溶液来吸收。写出吸收过程中反应的化学方程式 。
Na、Cu、O、Si、S、Cl是常见的六种元素。
(l)Na位于元素周期表第___周期第____族;S的基态原子核外有____个未成对电子;Si的基态原子核外电子排布式为___________
(2)用“>”或“<”填空:
| 第一电离能 |
离子半径 |
熔点 |
酸性 |
| Si_____S |
O2-_____Na+ |
NaCl_____Si |
H2SO4____HCl O4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是___________________。
(4)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目_________________。
无机化合物可根据其组成和性质进行分类,以下是一组对“一些物质与水反应”的分类图,请按要求填空:
(1)上述分类中,分成A、B两组的依据是____________________;
(2)C组物质与水反应的离子方程式为____________________;
(3)D组物质与水反应中,氧化剂和还原剂物质的量之比为1:1的物质有____________________;
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
(5分)向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1~2滴2 mol/L NaOH溶液,观察到有白色沉淀生成,该反应的离子方程式是________________。再滴加2滴0.1 mol/L FeCl3溶液,观察到白色沉淀转化为红褐色沉淀,该反应的离子方程式是___________________。由以上现象可以推知,相同条件下Mg(OH)2和Fe(OH)3中溶解度较大的是_________________。
无机化合物可根据其组成和性质进行分类:
(1)右图所示的物质分类方法名称是____________。
(2)以Na、K、H、O、C、S中任意两种或三种元素组成合适
的物质,分别填在下表②③⑥的后面。
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ②______ |
③______ ④Ba(OH)2 |
⑤Na2CO3 ⑥______ |
⑦CO2 ⑧K2O |
(3)写出⑦转化为⑤的 离子方程式:______________________________。
(4)实验室制备⑦常用______和______反应(写物质的化学式),检验该气体的方法是____________。
工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图所示:
试根据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是__________。
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式__________,制备中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?(已知Cu2++Cu+2Cl-═2CuCl↓) __________。
(3)还原过程中加入少量盐酸的作用是__________,加入NaCl且过量的原因是__________。
(4)合成结束后所得产品用酒精淋洗的目的是__________。
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式__________。
烟气中主要污染物为SO2、NO、NO2,可用如下工艺进行脱硫脱硝及产物回收。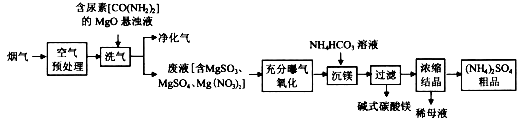
(1)空气预处理过程中,发生主要反应的化学方程式为____________________________。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体是_________________(填化学式)。
(3)充分曝气氧化过程中,发生反应的化学方程式为___________________。
(4)完成沉镁过程中生成碱式碳酸镁[MgCO3∙Mg(OH)2]的离子方程式
______Mg2++______= MgCO3∙Mg(OH)2↓+______CO2↑+______H2O
(5)(NH4)2SO4粗品中含有的主要杂质为__________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为________________。
①HCl、②过氧化钠、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是 (填序号,下同);上述四种物质加入紫色石蕊溶液中,溶液变红的是 。
(2)写出HCl的电离方程式 。
(3)写出过氧化钠与水反应的化学方程式___________________________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________。
(5)写出二氧化硅与氢氧化钠溶液反应的化学方程式_______________________。
在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g) Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。

①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为: 。
④原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。

①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。

①阳极的电极反应式为
②简述浓缩室中得到浓乳酸的原理:
③电解过程中,采取一定措施可控制阳极室pH约为6-8,此时进入浓缩室的OH-可忽略不计。
400mL 10 g•L-1乳酸溶液通电一段时间后,浓度上升为145 g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g• mol-1)
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和SiO2等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:

(1)实验室实现“操作I”所用的玻璃仪器有玻璃棒、 和烧杯;
(2)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 ,检验“酸溶”后的溶液中含有Fe2+的试剂及现象是 ;
(3)“操作Ⅲ”系列操作名称依次为 、冷却结晶、过滤和洗涤。洗涤沉淀的方法是 ;
(4)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式: 。
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右(写出最佳答案)

(1)沉淀1的化学式是 ,试剂C的名称是 ,分离出沉淀2的操作名称是 ;
(2)写出混合液+A的离子方程式
生成沉淀2的离子方程式
A~G各物质间的关系如图,其中B、D为气态单质。
请回答下列问题:
(1)物质C、E分别为 、 。(填名称)
(2)反应①可选用不同的A进行,若反应在常温下进行,其化学方程式为 。
(3)反应②的离子方程式为 。
(4)新配制的F溶液应加入________以防止其转化为G。请设计实验检验F、G的混合溶液中F的金属阳离子。(写出试剂、操作、现象、结论) 。