在过量FeSO4溶液中加入稀硫酸,再滴入几滴NaClO溶液,溶液立即变黄。
(1)上述反应的离子方程式为____________________________。
(2)为检验上述反应中的氧化产物,取少许上述反应后的溶液,加入KSCN溶液,溶液变红,证明氧化产物为Fe3+;为检验上述反应中的还原产物,请填写实验操作、现象和匹配的结论:取少许上述反应后的溶液,______________________________。
(3)为证明上述反应后的溶液中仍存在过量的Fe2+,可向其中滴加_______________溶液。
按要求书写下列反应的离子方程式
(1)CuSO4溶液与过量Ba(OH)2溶液反应:
(2)Al2(SO4)3溶液中加入过量氨水:
(3)将过量SO2气体通入冷氨水中:
(4)向NaAlO2溶液中通入过量CO2:
(5)0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:
按要求书写下列反应的离子方程式
(1)CuSO4溶液与过量Ba(OH)2溶液反应:
(2)Al2(SO4)3溶液中加入过量氨水:
(3)将过量SO2气体通入冷氨水中:
(4)向NaAlO2溶液中通入过量CO2:
(5)0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:
在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是 ,试解释易拉罐变瘪的原因 ,并解释后一现象的原因 ,写出反应过程中的两个离子方程式 、 。
(1)鉴别NaCl和Na2CO3溶液的试剂是 ,离子方程式为 ;
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 ;
(3)除去Fe2O3中SiO2的试剂是 ,离子方程式为 ;
(4)明矾在水中的电离方程式是 明矾可用作净水的原因是 。
请按要求写出:(1)过氧化钠与水反应的化学方程式:________________________。
(2)碳酸氢钠受热分解的化学方程式:________________________。
(3)Al与NaOH溶液反应的化学方程式:_________________________。
(4)用小苏打治疗胃酸过多的离子方程式:___________________________。
(5)在反应MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O(反应条件略去)中,氧化剂与还原剂的物质的量之比为________________________________。
某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:

回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
下列微粒中:①Na+;② Fe3+ ;③ Cl-;④HCO3-;⑤ AlO2-
(1)既能电离又能水解的微粒是 (填序号)。
(2)②、③两种离子组成的盐的水溶液显 (填“酸性”或“碱性”或“中性”),用离子方程式表示原因 。
(3)④、⑤两种离子在水溶液中会发生反应而生成沉淀,写出相应的离子方程式 。
完成离子反应,并改写成化学方程式
①_____+Ag+=___+Ag_________________。
②Fe2O3+_____=___Fe3++___________,__________________________。
将0.1molMg 、Al混合物溶于100mL3mol/LHCl中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:

(1)写出A→B段反应的离子方程式 。
(2)A点沉淀的总物质的量n= 。
(3)欲使Mg2+ 、Al3+刚好沉淀完全,则加入NaOH溶液的体积V2= mL。
(4)若V1="60mL" ,则混合物中Mg的物质的量n(Mg)= ,V3点所加NaOH溶液的体积为V3=________mL。
用离子方程式解释下列过程:
(1)纯碱溶液显碱性:____________________。
(2)泡沫灭火器的反应原理(硫酸铝溶液与小苏打):_______________________。
(3) AgCl的浊液中加入KI溶液,白色沉淀变为黄色:____________________。
已知0.1 mol/L的NaHSO4溶液中H+的物质的量浓度为0.1mo1/L,请下列问题:
(1)写出NaHSO4在水溶液中电离的方程式 。
(2)NaHSO4属于(填“酸”“碱”或“盐”) 。
(3)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为2:1混合,则反应的离子方程式是 。
(4)若将NaHSO4溶液逐滴滴入Fe(OH)3胶体溶液可观察到的现象是 。
向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示: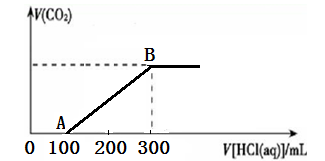
(1)OA段、AB段发生反应的离子方程式__________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是______________。
Ⅰ.在MgCl2溶液中滴入NaOH溶液,会有白色沉淀出现,该白色沉淀不能溶解于过量的氢氧化钠中。反应的离子方程式是 ;但Al(OH)3却能溶解在过量NaOH溶液中,该反应的离子方程式是 。
Ⅱ.在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示。
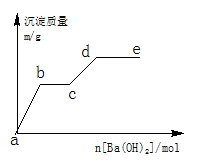
(1)a→b过程中发生反应的离子方程式是
(2)b→c发生反应的离子方程式是
(3)d点沉淀质量是 g。