下列反应的离子方程式书写中,正确的是( )。
| A.碳酸钡与盐酸反应:CO32—+2H+=H2O+CO2↑ |
| B.稀硫酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42—=BaSO4↓ |
| D.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
下列各组溶液不加任何试剂,只需要用试管和滴管两两互滴就能鉴别的是]
| A.盐酸、氢氧化钠、氯化钠 | B.氢氧化钠、氢氧化钡、硫酸 |
| C.硫酸氢钠、碳酸钠、氢氧化钠 | D.硫酸铜、盐酸、硫酸 |
下列各物质转化关系如图所示,A是一种高熔点固体,D是一种红棕色固体。
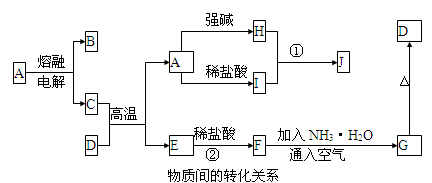
根据上述一系列关系回答:
(1)填写物质的化学式:B , G 。
(2)写出D物质中金属元素基态原子的核外电子排布图 。
(3)写出下列反应的离子方程式:
①H溶液和I溶液混合生成J___________ 。
②E和盐酸反应 。
(4)在电解熔融状态A的过程中,当电路中通过1mol电子时,阳极上产生的气体体积为 L。(标准状况下)
下列离子方程式书写正确的是
| A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑ |
| B.过量Ba(OH)2溶液与少量的NaHCO3溶液混合:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O |
| C.石英溶于NaOH溶液:Si4++2O2-+2OH-=SiO32-+H2O |
| D.硅酸钠溶液中滴加盐酸:SiO32—+2H+= H2SiO3↓ |
下列离子方程式书写正确的是( )
A.大理石和稀盐酸反应 CO32- + 2 H+ CO2 ↑ + H2O CO2 ↑ + H2O |
B.铜和稀硝酸反应 3Cu + 8H+ + 2 NO3-  3Cu2+ + 2NO↑+ 4H2O 3Cu2+ + 2NO↑+ 4H2O |
| C.氢氧化钡溶液加入稀硫酸中: OH- + H+ ="=" H2O |
D.铝和烧碱溶液反应 A1+ 2OH— A1O2—+ H2↑ A1O2—+ H2↑ |
下列离子方程式,正确的是( )
| A.硫酸氢铵和氢氧化钠等物质的量混合 NH4++OH-=NH3↑+H2O |
| B.向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-=BaSO3↓+SO32- +2H2O |
| C.将Fe2O3溶于氢碘酸中Fe2O3+6H+=2Fe3++3H2O |
| D.等物质的量的溴化亚铁跟氯气反应2Fe2++2Br-+2Cl2=2F3++Br2+4Cl- |
下列反应的方程式正确的是
| A.浓盐酸与铁屑反应的离子方程式:2Fe + 6H+ = 2Fe3+ + 3H2↑ |
| B.钠与CuSO4溶液反应的离子方程式:2Na + Cu2+ =" Cu↓+" 2Na+ |
| C.NaHCO3溶液与NaOH反应的离子方程式:HCO3—+ OH—= H2O+ CO2↑ |
| D.将CO2通入饱和碳酸钠溶液直至过量的离子方程式: |
2Na+ + CO2 + CO32- + H2O = 2NaHCO3↓
下列离子方程式书写正确的是( )
| A.盐酸中滴入碳酸钠溶液:CO32-+2H+=H2O+CO2↑ |
| B.铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2 |
| C.盐酸中滴入氢氧化钠溶液:HCl+OH-=H2O+C1- |
| D.稀硝酸滴在石灰石上:CO32-+2H+=H2O+CO2↑ |
环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: 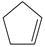 (g) =
(g) = 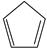 (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) = 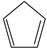 (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( 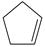 )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
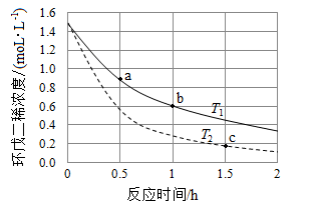
| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
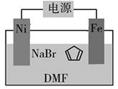

该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为________,其中氮的化合价为________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为________.
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJ•mol﹣1
上述反应热效应之间的关系式为△H4=________,联氨和N2O4可作为火箭推进剂的主要原因为________.
(4) 联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为________(已知:N2H4+H+⇌N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是________.联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________.
某校学生课外活动小组为测定Na元素的相对原子质量,甲同学设计的装置如右图,该装置(包括仪器、水和干燥剂)的总质量为ag,从实验室取出b g的钠(不足量,不含煤油)放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)该反应的离子方程式为 ;
(2)此干燥管的作用是 ;若此钠块有少量被氧化,则测出的相对原子质量会比实际相对原子质量 (填“偏大”、“偏小”或“不变”);
(3)乙同学认为此设计方案会使测定结果 (填“偏大”、“偏小”或“不变”),建议在图中干燥管上再连一个同样的干燥管且该干燥管不参与称质量,其目的是 ,计算钠的相对原子质量的表达式为____________;
(4)丙同学为避免由于行动不够迅速产生偏差,又建议在广口瓶中再加入一定量煤油,其目的是_ ___。
下列解释事实的离子方程式不正确的是
| A.Na放入水中,产生气体:2Na + 2H2O =2Na+ + 2OH-+ H2↑ |
| B.FeCl3溶液滴在淀粉碘化钾试纸上,试纸变蓝:2Fe3+ + 2I-= 2Fe2+ + I2 |
| C.铁溶于稀硝酸,溶液变黄:3Fe + 8H+ + 2NO3-= 3Fe2+ + 2NO↑+ 4H2O |
| D.Al片置于NaOH溶液中,产生气体:2Al + 2OH-+ 2H2O =2AlO2- + 3H2↑ |
下列反应的离子方程式书写正确的是
| A.硫酸和氯氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| B.碳酸钠与盐酸反应:Na2CO3+2H+=2Na++CO2↑+H2O |
| C.Ca(NO3)2溶液和Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| D.铁钉放入硫酸铁溶液中:Fe+Fe3+=2Fe2+ |
能用H+ + OH- =H2O 来表示的化学反应是( )
| A.固体C u ( O H ) 2和H2SO4溶液反应 |
| B.澄清石灰水和HNO3溶液反应 |
| C.KOH 溶液和醋酸溶液反应 |
| D.Ba(OH)2溶液和H2SO4溶液反应 |