已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质问的转化关系如图所示(某些条件已略去)。请回答:
(1)甲和水反应生成戊和丙的化学方程式为_______________________。
(2)乙与强碱反应的离子方程式:________________________。
(3)丁中所包含的化学键类型有___________________(填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
丙分子溶于水所得溶液中含有的氢键有____________种。
(4)利用单质B与D为原料、含H+的固体物质作电解质,以金属铂为电极材料组成原电池制备丙,则生成产物丙的电极反应式为______________。
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:______________。
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成l mol乙时放出536kJ热量,其热化学方程式为:___________。
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为________,该元素的符号是________。
(2)Y元素原子的价层电子的电子排布图为________,该元素的名称是________。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________________________________________________________。
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由
_________________________________________________________________________。
(10分)A、B、C、D均为中学化学常见的纯净物,且存在如图所示转化关系,其中A是单质。
(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质之一。写出B与C发生反应的化学方程式_________________________。
(2)若A、B、D均为两性物质,且A、B生成C的反应均需要强碱溶液。则B生成C的离子反应方程式为________________,在A生成C的反应中每消耗1mol还原剂,可生成气体_______________L(标准状况)。
(3)若组成A、B、C、D的元素为4种短周期元素a、b、c、d,其原子序数逐渐增大,且只有c为金属元素,a、d位于同一主族,b元素原子的最外层电子数是其电子层数的3倍,C、D均为正盐,C是普通玻璃的主要成分之一。则元素d在元素周期表中的位置是________,元素a的最高价氧化物对应水化物的水溶液中离子浓度由大到小的顺序为___________。
A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3﹕5。请回答:
(1)D的元素符号为 。
(2)F在元素周期表中的位置 。
(3)用电子式表示元素B与元素F形成的化合物: 。
(4)B单质与氧气反应的产物与C的单质同时放入水中,产生两种无色气体,有关的化学方程式为 、 。
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为 。
(6)某混合物的稀溶液中,只可能含有B、C、F构成的简单离子或A、E的最高价氧化物对应水化物所电离出来的阴离子。现分别取一定体积的该溶液进行实验。两次每次取200.00mL进行实验。
实验1:取2mL溶液,向其中加入AgNO3溶液有沉淀产生;
实验2:取200mL溶液,向其中加入足量BaCl2溶液后,得干燥沉淀12.54g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g。请回答:
①根据以上实验,不能判断是否存在的离子有 。
② B的简单离子是否存在 ;若存在,浓度至少为 mol/L(若不存在,则不必回答第二问)。
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。
甲 + H2O → 丙 + 丁
(1)转化关系中所涉及的反应为非氧化还原反应。
①若甲是一种钠盐,丁为两性氢氧化物,则甲的化学式为 ,丁的酸式电离方程式为 。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的电子式为 
(2)转化关系中所涉及的反应为氧化还原反应。
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是 。
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是 。
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族;E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6。
(1)E在元素周期表中的位置是 。
(2)由A、C、F三种元素按原子个数比1∶1∶1组成的化合物与BA3反应生成B的单质, 写出该反应的化学方式 。
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的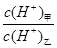 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(4)用图所示装置电解由D与F形成盐的饱和溶液时,若阴、阳极都用铁作电极,则阳极的电极反应式为 ,溶液中出现的现象是 。
(本题包括2部分,共14分)
Ⅰ、X、Y、Z、W均为短周期元素组成的单质或化合物。在一定条件下有如下转化关系:X+Y→Z+W
(1)若构成X的阳、阴离子个数比为1︰2,且构成X的阳、阴离子中分别含有18个和10个电子,构成Z的阴、阳离子中均含有10个电子。则Z的电子式为 。
(2)若X、Y、Z、W四种物质均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则此化学反应的类型为 。
(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为 。
(4)若X、Y、Z、W均为非金属氧化物,X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则该反应的化学方程式为 。
Ⅱ、(6分)我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
请根据以上信息回答下列问题:
(1)写出N的化学式和B的名称:N 、B 。
(2)写出反应②的化学方程式并用双线桥表示电子转移情况:
(3)写出反应③的离子方程式:
(10分)在下图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,所含离子数目比为1:2;B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体。
完成下列问题:
(1)写出A的化学式 。(2)组成F的元素在周期表中位于 周期 族。
(3)B的电子式是 。 (4)反应①的化学方程式: 。
(5)反应②的离子方程式: 。
A、B、C、D、E都是短周期元素,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 乙物质的电子式是__________
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是_________ (用元素符号填写)
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是
(4)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,其中有一种产物是TiC(在火箭和导弹上有重要应用)其反应方程式为
(10分)短周期元素A、B、C、D、E原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙;D与A位于同一主族;在同周期元素形成的简单离子中,E的离子半径最小。
(1)实验室中可用A2C2制取C单质,其化学方程式是
(2)由A、C、D三种元素组成的化合物的电子式是 ;B、C、E三种元素组成的常见盐的水溶液呈酸性,原因是 (用离子方程式表示)。
(3)反应乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是 (填“正”或“负”)极,在碱性条件下其电极反应是
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
(1)M固体的晶体类型是 ,M中所含化学键有:
(2)YO2分子的立体构型名称为: ;
G分子中X原子的杂化轨道的类型是 。
(3)J的水溶液跟AgNO3溶液反应的化学方程式为: 。
(4)R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
氮化硼()晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。

⑴基态硼原子的电子排布式为。
⑵ 关于这两种晶体的说法,正确的是(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
⑶六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为,其结构与石墨相似却不导电,原因是。
⑷立方相氮化硼晶体中,硼原子的杂化轨道类型为。该晶体的天然矿物在青藏高原在下约300的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是。
⑸(氟硼酸铵)是合成氮化硼纳米管的原料之一。1
含有
配位键。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)五种元素原子半径由大到小的顺序是(写元素符号)_______________________________
(3)QX的电子式为___________;QX与水反应放出气体的化学方程式为_____________________
(4)X、Z两元素所形成化合物的电子式为 (5)由以上某些元素组成的化合物A、B、C、D有如下转化关系
其中C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式__________________;
D的电子式_____________________________
如果A、B均由三种元素组成,B为两性不溶物,
由A转化为B的离子方程式_________________________________________________
A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号A: ,B: ,C: 。
(2)D2A的电子式 ,BA2的结构式 。
(3)D2A2的化学式 ,灼烧这化合物火焰呈 色。
(4)C在元素周期表中的位置是 ,其原子结构示意图为 。
(5)比较A、B气态氢化物的沸点 ;原因 。
铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。②CO常温下为气体,固态时属于 晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。 [Cu(NH3) n]+中Cu+与n个氮原子的空间结构呈 型,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
请回答下列问题:
①该配离子[Cu(En)2]2+中的中心原子的基态外围电子排布式为 。
②乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
③该配离子[Cu(En)2]2+中存在的作用力类型有 (填字母);
A配位键 B极性键 C离子键
D非极性键 E.氢键 F.金属键