(Ⅰ)六种短周期元素在元素周期表中的相对位置如图所示。其中R元素的最外层电子数是次外层电子数的一半。
| X |
Y |
Z |
M |
| R |
|
W |
|
请回答下列问题:
(1)画出R的原子结构示意图 。
(2)比较Z、W的简单氢化物沸点高低并说明原因 。
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%。则化合物甲的化学式为 。
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无机高分子混凝剂、净水剂。实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:
(4)FeSO4溶液显弱酸性的原因是 (用离子方程式表示)。
(5)加入浓硫酸调节pH的作用是:① ;② 。
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。此过程发生的部分反应为:
Sn2++2Hg2++8Cl- = Hg2Cl2↓+SnCl62-
Cr2O72-+14H++6Fe2+ = 2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是 。
②称取聚铁质量为10.00 g配成100.0 mL溶液,取出20.00 mL,经上述方法处理后,用0.1000 mol·L-1 K2Cr2O7标准溶液滴定。达到终点时,消耗K2Cr2O7标准溶液12.80 mL。则聚铁中铁元素的质量分数为 %。
如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
|
|
② |
③ |
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
|
(1)③、④、⑦的原子半径由大到小的顺序为 (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 。
④写出过量的E与F溶液中溶质反应的离子方程式 。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
|
③ |
|
| 3 |
④ |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
⑨ |
| 4 |
⑩ |
|
|
|
|
|
|
|
(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号或化学式,下同),非金属性最强的元素是: 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是:_______,碱性最强的化合物的化学式是:_____________。
(3)最高价氧化物是两性氧化物的元素是:_________;写出它的最高价氧化物与氢氧化钠反应的离子方程式:____________________________________。
(4)④与⑧形成的化合物的电子式是: ,该化合物所含化学键类型是: (填“共价键”或“离子键”)。
(5)试设计实验方案比较④与⑤的化学性质(金属性),有关实验步骤、现象和结论填入下表
| 实验步骤 |
实验现象与结论 |
| |
|
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系。请回答下列问题:
(1)Y在元素周期表中位于第____周期、第 族;P的基态原子核外电子排布式为________。
(2)Y、P、R第一电离能大小的顺序为 (用化学符号表示,下同),X、R、W的气态氢化物水溶液酸性大小顺序为 。
(3)X、Z的单质按物质的量比1:2反应生成的化合物中化学键类型有 ;计算2mol该化合物与标准状况下33. 6LCO2和l0mol水蒸气混合物充分反应后转移电子的物质的量是 。
(4)Q单质与Z的最高价氧化物对应水化物的浓溶液反应,化学方程式为 。
(5)已知:反应I CaSO4( s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H=+218.4kJ/mol
CaO(s)+SO2(g)+CO2(g) △H=+218.4kJ/mol
反应Ⅱ CaSO4(s)+4CO(g) CaS(s)+4CO2(g) △H=-175.6kJ/mol
CaS(s)+4CO2(g) △H=-175.6kJ/mol
假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是 
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
请用化学用语回答下列问题: (1)D元素在周期表中的位置:
(1)D元素在周期表中的位置:
(2)A、D 、E元素简单离子半径由大到小的顺序为____>_____ >_____ (填微粒符号 ) (3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(3)F与D同主族且相邻,其气态氢化物稳定性的大小 > (填微粒符号)
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式 ,该阳离子中存在的化学键有 。 (5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因 .
(6) 化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式 。
(7)在Fe和Cu的混合物中加入一定量C的最高价氧化物的水化物稀溶液,充分反应后,剩余金属m1 g;再向其中加入稀硫酸,充分反应后,金属剩余 m2 g 。下列说法正确的是 。
a.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Cu2+
b.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Fe2+
c.m1一定大于m2
d.剩余固体m1 g 中一定有单质铜,剩余固体m2 g 中一定没有单质铜
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
(14分)下表为元素周期表的一部分:(用元素符号或化学式填空)
| 族 周期 |
|
|||||||
| |
① |
|
|
|||||
| |
|
|
|
|
|
② |
|
|
| |
③ |
|
|
④ |
|
⑤ |
⑥ |
|
(1)写出元素④在周期表中的位置______________。
(2)②、③、⑤的原子半径由大到小的顺序为_________________________。
(3)④、⑤、⑥的气态氢化物的稳定性由强到弱的顺序是_________________________。
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
(1)写出固体A与液体X反应的离子方程式 。
(2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D的溶质为 (填化学式)。
(3)写出气体C与气体Y反应的化学方程式 。
根据物质相似性、特殊性来学习元素性质是常见的学习方法。
(1)铍(Be)与铝元素相似,其氧化物及氢氧化物具有两性,请写出BeO与盐酸反应的离子方程式_____,Be(OH)2溶于NaOH溶液的化学方程式为:Be(OH)2+2NaOH=Na2 BeO2+2H2 O,往10.0mL1.00mol·L-1的Be(NO3)2溶液中逐滴加入等浓度的NaOH溶液,请在以下坐标图中画出沉淀量随NaOH溶液加人量的变化图:
(2)锗与硅元素相似,锗也是良好的半导体,以下是工业冶炼锗的简单流程图:
①GeCl4的晶体类型为__________。
②写出过程III发生反应的化学方程式__________。
③以下有关工业冶炼锗的说法正确的是__________。
| A.GeO2与SiO2性质相似,均易与盐酸反应 |
| B.过程II的蒸馏是利用GeCl4难溶于水的性质实现的 |
| C.过程IV发生的反应中,GeO2作氧化剂 |
| D.上述过程涉及的基本反应类型有复分解反应、置换反应 |
(3)某同学为了探究硫与浓硝酸的反应产物,将硫与浓硝酸混合,结果生成一种纯净无色气体A,A遇空气变红棕色,据此写出硫与浓硝酸反应的化学方程式___________________。
LiAlH4由Li+、A1H4一构成,是有机合成中常用的还原剂。
(1)Al元素在周期表的位置是第__________周期__________族。
(2)比较离子半径大小:Li+__________ H一(选填“>"、“<”或“=”)。
(3)LiAlH4中含有的化学键类型为____________________________________。
(4)LiAlH4中氢元素的化合价为__________,它与水反应生成的单质气体为__________。
(5)LiCl溶液显酸性,用离子方程式说明原因____________________________________。
(6)如图所示,已知75%A的水溶液常用于医疗消毒,则A的结构简式为__________;CH3COOH与A在浓硫酸催化下生成B的有机反应类型为__________。
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
请回答下列问题。
(1)C原子基态时电子排布式为 。
(2)B、C两种元素第一电离能为 (用元素符号表示)。试解释其原因: 。
(3)任写一种与AB-离子互为等电子体的离子 。
(4)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式 。
(6)D和E形成的化合物的晶胞结构如图,其化学式为 ;∠EDE= ;E的配位数是 ;已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm。(用ρ、NA的计算式表示)
(12分)根据下列某些短周期元素中元素性质回答问题。
| |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
| 原子半径/10 -10m |
0.37 |
1.86 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.52 |
0.75 |
0.71 |
| 最高价态 |
+1 |
+1 |
|
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
|
| 最低价态 |
-1 |
|
-2 |
|
-4 |
-3 |
-1 |
|
-3 |
-1 |
(1)元素③、⑥和⑨的氢化物中沸点由高到低的顺序是__________ (填化学式)。
(2)元素①和⑨形成阳离子 ,其结构式为__________________。
(3)某元素R的原子半径为1.02×10 -10m ,它与钠形成Na2R2,其电子式是_________(R用元素符号表示)。
(4)元素②和⑦形成晶体的部分结构可用下图中的_________来表示(填序号)。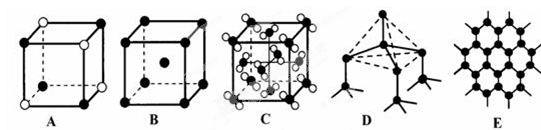
(5)①、③、⑨可以形成原子个数之比为4:3:2的中学常见无机化合物,该化合的水溶液显酸性的原因是_________________(用离子方程式表示),其水溶液中离子浓度由大到小的顺序是___________________。
现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物。回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式 。
(2)CS2和B、D元素形成的一种化合物为等电子体,则CS2的分子结构为 ,1molCS2中含有的π键为 个。
(3)Y的中心原子的杂化轨道类型为 ,分子的立体构型为 。
(4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,用离子方程式表示Z溶液显碱性的原因 。等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为 。
(5)有一种氮化钛晶体的晶胞如图所示,钛原子的电子排布式为 ,该氮化钛的化学式为 ,氮原子的配位数为 。晶胞中N、Ti之间的最近距离为apm,则氮化钛的密度为 g.cm3(NA为阿佛加德罗常数值,只列式计算)。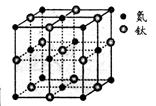
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素D在周期表中的位置是 。
(2)该配位化合物的化学式为 。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61×10-8cm,则E的密度为 ;EDC4常作电镀液,其中DC 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。
【化学------选修物质结构与性质】
五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲和丙同族,乙离子和丙离子具有相同的电子层结构。甲和乙、丁、戊均能形成共价型化合物。甲和乙形成的化合物在水中呈碱性,单质丁在单质戊中可燃烧产生白色烟雾。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 ;(填元素符号)
(2)由甲和乙、丁、戊所形成的共价型化合物中,热稳定性最差的是 ;(用化学式表示)
(3)甲和乙形成的化合物的中心原子的杂化类型为 ;甲和乙形成的化合物可与甲和戊形成的化合物反应,其产物中存在的化学键类型为 ;
(4)除乙外,上述元素的电负性从大到小依次为 ;(填元素符号)
(5)单质戊与水反应的离子方程式为
(6) 一定条件下1.86g单质丁与2.912L单质戊(标准状况)反应, 则产物为 ,(用化学式表示)其物质的量之比为 。
【化学——选修化学与技术】
明矾石经处理后得到明矾[ KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 ;
(2)从水浸后的滤液中得到K2SO4晶体的方法是 ;
(3)A12O3在一定条件下可制得AIN,其晶体结构如图所示,该晶体中Al的配位数是 ;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新
型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程
式是 ;
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是 ;
(6)焙烧948吨明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫
酸 吨。