已知:硫酸铜溶液中滴入氨基乙酸钠(H2N—CH2—COONa)即可得到配合物A。其结构如右图:
(1)Cu元素基态原子的外围电子排布式为 。
(2)1mol氨基乙酸钠中含有σ键的数目为 。
(3)氨基乙酸钠分解产物之一为二氧化碳,写出二氧化碳的一种等电子体 (写化学式)。已知二氧化碳在水中溶解度不大,却易溶于二硫化碳,请解释原因 。
(4)硫酸根离子的空间构型为 ;已知:硫酸铜灼烧可以生成一种红色晶体,其结构如右图,则该化合物的化学式是 。
已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有7个电子.
请回答下列问题:
(1)G基态原子的核外电子排布式是 ;
(2)C、D、E的第一电离能由大到小的顺序是:
(3)下列有关上述元素的说法中,不正确的是 (填字母)
a.B单质的熔点在同族单质中最高
b.1mol A 2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含 个σ键。
(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为 ;
(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“•”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为 。
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C< B < E< D
Ⅱ.原子的最外层电子数:A=D C=E A + B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)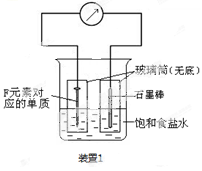
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 。
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
试回答以下问题
(1)B在周期表中的位置是 。B的氢化物与E的氢化物比较,沸点较高的是 (填化学式),在水中溶解度较大的是 (填化学式)
(2)写出D3B与甲反应所得溶液呈 (填“酸性”、“碱性”或“中性”),原因是(用化学方程式表示) 。
(3)写出丙的电子式为 。说明丙的水溶液在放置过程中其酸性会增强的原因(用离子方程式表示) 。
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。可用来鉴别丁和氯化钠的试剂有
A.氢碘酸和淀粉的混合液 B.AgNO3溶液
C.甲基橙试剂 D.稀硫酸
(5)将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式 。
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是 周期 族。
(2)A与C形成的18电子分子的结构式为 。
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如右图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
A.B4比P4(白磷)既含有极性键又含有非极性键
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为 。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K |
303 |
313 |
323 |
| BA3生成量/(10-1mol) |
4.3 |
5.9 |
6.0 |
氮元素可形成叠氮化物及络合物等。
(1)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①写出与N3-互为等电子体的分子: ,N3-的空间构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co (N3)(NH3)5]SO4、Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。CN-中C原子的杂化类型是 。
(2)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是 (选填序号)
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
| C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.氮气常温下很稳定,是因为氮的电负性小 |

(3)对氨基苯酚( )的沸点高于邻氨基苯酚(
)的沸点高于邻氨基苯酚( )的沸点(填:“大于”、“小于”、“等于”),理由是
)的沸点(填:“大于”、“小于”、“等于”),理由是
今有甲、乙、丙、丁四种元素。已知:甲元素是自然界中含量最多的元素;乙元素为金属元素,它的原子核外K层、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素单质中燃烧火焰呈苍白色。
(1)试推断并写出甲、乙、丙、丁四种元素的名称和符号;
(2)写出几种上述元素两两化合形成的化合物的化学式。
已知M2+3d轨道上有5个电子,试推出:
(1)M原子的核外电子排布。
(2)M原子的最外层和最高能级组中电子数各为多少?
(3)M元素在周期表中的位置。
由下列元素在周期表中的位置,写出元素原子的价电子排布式。
(1)第4周期ⅥB族;
(2)第5周期ⅠB族;
(3)第5周期ⅣA族;
(4)第6周期ⅡA族;
(5)第4周期ⅦA族。
已知X元素原子的K、L层的电子数之和比L、M层的电子数之和多1个电子。Y元素的原子最外层电子数比内层电子数少3个。Z元素核外有3个电子层,最外层有3个电子。W元素最高化合价是最低化合价绝对值的3倍,它在最高价氧化物中的质量分数为40%。
(1)Y和W的气态氢化物的稳定性为(用化学式表示) > 。
(2)X单质在空气中加热生成的化合物是 化合物(填“离子”或“共价”)。
(3)X和Z的最高价氧化物对应水化物反应的离子方程式 。
(4)W的低价氧化物与Y单质的水溶液反应的化学方程式 。
(5)Y与Z形成化合物的化学式是 。实验测得当此化合物处于固态和液态时不导电,溶于水能导电。由此判断该化合物具有 键(填“离子”或“共价”)。
短周期主族元素A、B、C、D、E、F 的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1∶1的原子个数比形成的化合物的电子式: _____ 。F的原子结构示意图为: 。
(2)B、D形成的化合物BD2中存在的化学键为 键(填“离子”或“共价”,下同)。A、C、F三种元素形成的化合物CA4F为 _____ 化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)A、C、D、E的原子半径由大到小的顺序是 (用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 ____ 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
X、Y、Z、W是原子序数依次增大的四种短周期元素。X与W可形成四面体形的共价化合物,该化合物常用作灭火剂。Y的次外层电子数等于其最外层和最内层电子数之和的2倍,Y、Z的最外层电子数之和等于W的最外层电子数。
(1)用化学符号表示X的一种核素 。
(2)写出Y的单质与X的最高价氧化物反应的化学方程式 。
(3)Z的单质在W的单质中燃烧,生成的产物中各原子的最外层均达到8电子稳定结构的分子为 。
(4)用电子式表示Y与W形成化合物的过程为 。
(5)XW4的电子式为 。
(6)W的氢化物R是实验室一种常用试剂的主要成分,该试剂可用于实验室多种气体的制备,写出实验室制取气体时满足下列条件的离子方程式。
①R作氧化剂: 。
②R作还原剂: 。
(8分)今有A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素,D元素在第3周期中电负性最大。
(1)试推断A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合生成的常见化合物的化学式。