当n=4时(n为主量子数,n值所表示的电子运动状态称为电子层),电子层的最大容量为________个电子,如果没有能级交错,该层各轨道的能量由高到低的顺序为________。
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 ;
(2)Y元素原子的价层电子的轨道表示式为 ,该元素的名称是 ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 ;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程是 ;
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由 。
A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期。A显负价时,不能被任何氧化剂氧化;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒。回答:
(1)写出五种微粒的符号:A 、B 、C 、D 、E 。
(2)C的同位素名称:C2 。
(3)C和D形成分子的电子式为 ,空间结构为 。
有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1)B在周期表中的位置______________。
(2)CB2通入A2B2溶液中可被氧化为W,方程式为____________。用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)
电池总反应可表示为:PbO2 +Pb+ 2W= 2PbSO4 + 2H2O 。若电池中转移0.1 mol电子时,则W的浓度由质量分数39 % (密度1.3 g·cm-3)变为____________mol·L-1。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为_________________________。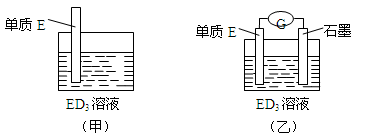
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为________________。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是 。
根据表中左栏信息,回答右栏有关问题:
| 信 息 |
问 题 |
| ①短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数。其中X是形成化合物种类最多的元素。 |
(1)X元素的最高价氧化物的电子式是 |
| ②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液。 |
(2)Z元素在元素周期表中位于第_____周期,_____族。 |
| ③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成。 |
(3)写出生成白色沉淀的化学方程式 。 |
| ④向上述四种元素的单质的混合物中加入足量的烧碱,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中有白色沉淀。 |
(4)最终生成白色沉淀的离子方程式为 。 |
| ⑤X、Y、Z、W四种元素的原子半径由大到小的顺序为____________(用元素符号表示) |
卤族元素包括F、Cl、Br等元素。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 。
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 ,该功能陶瓷的化学式为 。
(3)BCl3和NCl3中心原子的杂化方式分别为 和 。第一电离能介于B、N之间的第二周期元素有___ 种。
(每空2分,共12分)已知X、Y、Z、W、L为五种短周期元素,非金属元素X最外层电子数与其周期序数相同,Y的最外层电子数是其所在周期数的2倍。Y在Z中充分燃烧能生成其最高价化合物YZ2。W+与Z2-具有相同的电子数。X在L中燃烧,产物XL溶于水得到一种强酸。请回答下列问题:
(1)X在周期表中的位置是 。请写出实验室制备单质L的化学方程式 ,尾气处理的离子方程式: 。
(2)由X分别与Y、Z形成的最简单化合物的稳定性关系为: 。
(3)由X、Y、Z、W组成的一种盐,在面食中有大量使用,其俗名为: ,在其水溶液中滴入由X、Y、Z形成的日常生活中常见的一种酸,反应的离子方程式为: 。
下表是元素周期表的一部分,根据要求回答下列问题。
| A |
|
|
|
|
|||||||||||||
| |
|
|
E |
F |
J |
H |
|
||||||||||
| B |
|
D |
|
|
I |
G |
|
||||||||||
| C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
(1)元素I位于周期表中的位置 。
(2)B、C、D三种元素的最高价氧化物对应的水化物,其中碱性最强的是_______(填化学式)。
(3)H、K、G三种元素对应的氢化物中热稳定性最强的是________(填化学式)。
(4)某离子化合物只含有A、F、J三种元素,该化合物是 (填化学式)。
(5)写出D元素最高价氧化物与B元素最高价氧化物对应水化物反应的离子方程______。
下表是元素周期表一部分,列出了九种元素在周期表中的位置:
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
|
|
|
⑤ |
⑥ |
⑦ |
⑧ |
|
| 3 |
① |
③ |
④ |
|
|
|
⑨ |
|
| 4 |
② |
|
|
|
|
|
|
|
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是 ,在③~⑦元素中,原子半径最大的是 ;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式)。写出①和④的最高价氧化物对应的水化物反应的离子方程式 。
(3)用电子式表示③和⑨形成的化合物的形成过程 。
(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式: ,该物质所含化学键类型 ,0.1mol X与水反应转移电子数为: 。
(5)表中元素⑥和⑧可形成一种相对分子量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式 。
下图是各个原子的性质和原子序数(1~20)的关系图,各图的纵轴可能代表下列的某一性质:质量数、质子数、中子数、最高正价、原子半径相对大小、得电子相对能力。图3中原子序数8、9和图4中原子序数2、10、18在纵轴上没有对应的数值。
(1)图1~图4的纵轴分别代表________、________、______。
(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,G的最高价含氧酸的产量是衡量一个国家化工实力的标志。它们的原子序数存在如下关系:a+b=c,(e+c)/2=c,(c+e)/2=d,请根据提供的信息,回答下列问题:
①下图是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置。
②写出铜与上述某一元素最高价氧化物对应水化物反应的化学方程式: _________(任写一个即可)。
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y―→Z+W。若X为单质,Y、Z、W均为化合物,其相应的化学方程式为__________;若X、Y、Z、W均为化合物,其相应的化学方程式为______________________________(任写一个,合理即可)。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为__ _ _ _ _ 。
(3)G、H和I的第一电离能数值由大到小的顺序为: (用元素符号作答)。
(4)由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
(5)要证明太阳上是否含有R 元素,可采用的方法是 。
(6)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有___________(填元素符号)
②MO=Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___________(填分子式)。
下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 氢化物的沸点(℃) |
-60.7 |
-33.4 |
-111.5 |
100 |
-87.7 |
19.54 |
-84.9 |
-161.5 |
| 最高化合价 |
+6 |
+5 |
+4 |
|
+5 |
|
+7 |
+4 |
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是 (用表中元素编号填写)。
写出H的最高价氧化物的结构式: 。
(2)比较A、D、G三种简单阴离子的半径大小:r( )>r( )>r( )。比较元素F、G的氢化物的沸点高低,并说明理由 (均用实际的元素符号表示)。
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是: 。
(5)以下说法正确的是 (填编号)。
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现
下图是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
| 主族 周期 |
ⅠA |
|
0族 |
|||||
| 一 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 二 |
|
|
|
② |
|
③ |
|
|
| 三 |
④ |
|
|
⑤ |
|
|
⑥ |
|
(1)最活泼的金属元素是 (填元素符号),②和⑤两种元素原子半径较大的是 (填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的元素是 (填元素符号);
(2)写出①单质在⑥单质中燃烧的化学方程式 。
(3)①②③三种元素能够形成多种有机化合物,其中一种不仅是厨房调味剂而且还能除去水垢。写出此物质的结构简式: ;写出该物质与NaHCO3反应的化学方程式:____________。
下表是元素周期表的一部分:
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是 ,非金属性最强的元素是 。
(2)化学性质最不活泼的元素是 ,其原子结构示意图为 。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是 。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是 。
(5)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是 。
X、Y、Z、R、T是原子序数依次增大的短周期主族元素,X、R在周期表中的相对位置如下表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数;Z是地壳中含量最多的金属元素。
(1)X的最高价氧化物的电子式是_________,元素T在周期表中的位置是________________。
(2)Z和T形成的化合物在潮湿的空气中冒白色烟雾,该反应的化学方程式为________________。
(3)Y的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________。
(4)已知由X和R形成的液态化合物XR2的燃烧热是1075 kj/mol,试写出表示其燃烧热的热化学方程式________________