湖南省怀化市高一下学期期末化学试卷
2014年5月7日南京某建设公司丢失用于材料探伤的放射源 一枚,Ir是第VIII族元素,下列关于
一枚,Ir是第VIII族元素,下列关于 的说法正确的是
的说法正确的是
A. 核外含有115个电子 核外含有115个电子 |
B.Ir为非金属元素 |
C. 的中子数是115 的中子数是115 |
D. 的质量数是77 的质量数是77 |
下列说法不正确的是
| A.pH<7的雨水就是酸雨 |
| B.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对坏境的影响 |
| C.含氮、磷的大量污水任意排放是导致水华的主要原因 |
| D.垃圾是放错地方的资源,应该分类回收利用 |
下列化学用语表述正确的是
| A.一氯甲烷的结构式CH3C1 | B.苯的分子式C6H6 |
| C.葡萄糖的结构简式C6H12O6 | D.氮气的电子式 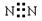 |
下列说法不正确的是
| A.煤和石油都是混合物 |
| B.石油通过催化重整可获得环状烃 |
| C.煤的干馏和石油的分馏发生的都是化学变化 |
| D.用溴的四氯化碳溶液可鉴别分馏获得的汽油和裂化获得的汽油 |
某有机物A的结构为CH3—CH=CH—CH2OH,它不可能发生的反应是
| A.与氢氧化钠溶液反应 | B.使溴的四氯化碳溶液褪色 |
| C.与金属钠反应放出氢气 | D.使高锰酸钾溶液褪色 |
已知1~18号元素的离子aW3+、bX+、cY2-、dZ - 都具有相同的电子层结构,下列关系正确的是
| A.离子的还原性:Y2->Z- | B.质子数:c>b |
| C.氢化物的稳定性:H2Y>HZ | D.原子半径:X<W |
X元素最高价氧化物对应的水化物为HXO3,它的气态氢化物为
| A.HX | B.XH3 | C.H2X | D.XH4 |
下列说法正确的是
| A.碱金属单质的密度随着原子序数的增大而增大 |
| B.碱金属单质都是银白色金属 |
| C.在周期表中金属与非金属的分界处,可以找到半导体材料 |
| D.所有气体单质都含有非极性键 |
下列说法不正确的是
| A.淀粉中加碘水后变蓝 |
| B.将苯滴入溴水中,振荡后水层接近无色 |
| C.蛋白质水解能得到氨基酸 |
| D.淀粉和纤维素互为同分异构体 |
在2A(g)+B(g) 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A.υ(A)=0.5 mol·L−1·s−1 B.υ(D)=1 mol·L−1·s−1
C.υ(C)=1.2 mol·L−1·s−1 D.υ(B)=0.5 mol·L−1·s−1
在恒容密闭容器中发生反应2SO2+O2  2SO3,当其他条件不变时,只改变一个条件,不能加快化学反应速率的是
2SO3,当其他条件不变时,只改变一个条件,不能加快化学反应速率的是
| A.增加SO2的浓度 | B.充入一定量惰性气体 |
| C.升高温度 | D.使用催化剂 |
下列说法中正确的是
| A.物质发生化学反应时都伴随着能量变化,伴随能量变化的变化一定是化学变化 |
| B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
| D.因为3O2===2O3是吸热反应,所以臭氧比氧气更稳定 |
燃料电池是一种新型电池,它主要是利用燃料燃烧原理把化学能直接转化为电能。氢氧燃料电池的基本反应是:X极:1/2O2(g)+H2O(l)+2e-===2OH-;Y极:H2(g)+2OH--2e-===2H2O(l)。下列说法正确的是
| A.X是正极 | B.Y是正极 |
| C.Y极发生还原反应 | D.电子由X极移向Y极 |
下列说法正确的是
| A.阴、阳离子之间通过相互吸引作用形成的化学键叫离子键 |
| B.根据电离方程式HCl=H++Cl-,可判断HC1分子里存在离子键 |
| C.化学键的断裂和形成是化学反应能量变化的主要原因 |
| D.离子化合物一定由金属元素和非金属元素组成 |
X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法不正确的是
| A.Y元素最高价氧化物对应水化物的化学式为HYO4 |
| B.原子半径由小到大的顺序为W<X<Z |
| C.X与W可形成W2X、W2X2两种物质 |
| D.Y2与W2在冷暗处爆炸 |
下列反应中,既属于氧化还原反应,又是吸热反应的是
| A.NaOH与HCl的反应 | B.灼热的碳与二氧化碳的反应 |
| C.Ba(OH)2·8H2O与NH4Cl的反应 | D.酒精在空气中的燃烧反应 |
下列实验不能获得成功的是
| |
实验目的 |
实验步骤 |
| A. |
探究催化剂对化学反应速率的影响 |
向H2O2溶液中滴加少量FeCl3溶液 |
| B. |
探究乙醇能发生氧化反应 |
将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. |
探究石蜡油分解的产物不都是烷烃 |
将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. |
探究蔗糖水解的产物中是否含有葡萄糖 |
取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 |
已知1 mol氢气完全燃烧生成水蒸气时放出242 kJ的能量,且氧气中1 mol O===O键完全断裂时需要吸收496 kJ的能量,水蒸气中1 mol H—O键形成时放出463 kJ的能量,则氢气中1 mol H—H键断裂时吸收的能量为
| A.436 kJ | B.557 kJ | C.920 kJ | D.181 kJ |
下表是元素周期表的一部分,根据要求回答下列问题。
| A |
|
|
|
|
|||||||||||||
| |
|
|
E |
F |
J |
H |
|
||||||||||
| B |
|
D |
|
|
I |
G |
|
||||||||||
| C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
(1)元素I位于周期表中的位置 。
(2)B、C、D三种元素的最高价氧化物对应的水化物,其中碱性最强的是_______(填化学式)。
(3)H、K、G三种元素对应的氢化物中热稳定性最强的是________(填化学式)。
(4)某离子化合物只含有A、F、J三种元素,该化合物是 (填化学式)。
(5)写出D元素最高价氧化物与B元素最高价氧化物对应水化物反应的离子方程______。
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则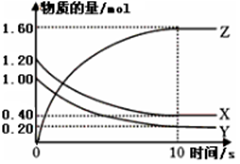
①反应的化学方程式为___ __________。
②0~10s内,用Z表示的化学反应速率________ ____。
③X的转化率为________________。
(2)向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:

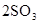
下列有关说法不正确的是( )
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当O2的浓度不变时,反应达到平衡状态 |
| C.当单位时间生成a mol O2,同时生成2a mol SO2时,反应达到平衡状态 |
| D.SO2和O2的转化率相等 |
将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)上图两装置中能构成原电池的是 (填甲或乙)。
(2)当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子的物质的量为 。
(3)现有如下两个反应:A:NaOH+HCl=NaCl+H2O ;B:Fe+2Fe3+= 3Fe2+,根据两反应的本质,判断 不能设计成为原电池(填A或B),不能的原因是 。
乙烯是来自石油的重要有机化工原料,它的产量可以用来衡量一个国家的石油化工发展水平。结合以下路线回答:
已知:
(1)乙烯分子中有_ _个原子共面。
(2)CH3CH2OH中官能团的名称是 __。
(3)反应I的化学方程式是_________________,反应类型是__ ___。
(4)反应IV的化学方程式是__________ ,反应类型是 _。
如图是制取溴苯的装置,试回答: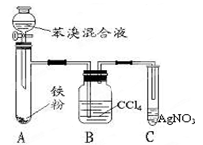
(1)装置A中发生有机反应的化学方程式是_ _。
(2)装置C中的现象是____ 。
(3)如果没有B装置,将A、C直接相连,你认为是否妥当? (填是或否)。
(4)实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:
①蒸镏②水洗③用于燥剂干燥④10%NaOH溶液洗⑤水洗正确的操作顺序是( )
A.①②③④⑤ B.④②③①⑤ C.②④⑤③① D.②④①⑤③
海洋资源的利用具有广阔前景。
(1)下列不属于海水淡化的方法___________________(填序号)。
A.蒸馏法 B.离子交换法 C.过滤法 D.电渗析法
(2)下图是从海水中提取镁的简单流程。
①试剂B是________(填化学式)。
②由无水MgCl2制取Mg的化学方程式是________________________。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
I:下列不属于步骤①操作所用的仪器是 ________(填序号)。
A.酒精灯 B.漏斗 C.坩埚 D.泥三角
II:步骤③的实验操作名称是__________。
III:④步骤反应的离子方程式________。
IV:请设计一种检验提取碘后的水溶液中是否含有碘单质的简单方法 。
 和
和


 粤公网安备 44130202000953号
粤公网安备 44130202000953号