下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1) 在这些元素中,化学性质最不活泼的是:_____________ (填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3) 最高价氧化物是两性氧化物的元素是___________;写出它的氧化物与氢氧化钠反应的离子方程式________________________。
(4) 用电子式表示元素④与⑥形成的的化合物的形成过程______________________ ,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)元素①与⑦形成的的化合物的电子式为__________________,该化合物是由___________ (填“极性”“非极性”)键形成的。
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。请回答:
(1)用电子式表示A和C组成的化合物的形成过程为__________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是 ;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式(本题涉及的含C元素的物质均易溶于水): 。
门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物的水化物为两性氢氧化物。试比较元素的非金属性Si________Ge(用“>”或“<”表示)。
②若锗位于硅的下一周期,写出“锗”在周期表中的位置________。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是________。
③硅和锗单质分别与H2反应时,反应较难进行的是________(填“硅”或“锗”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因____________。冶炼金属镓通常采用的方法是____________。
②为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、____和____。
A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期。A显负价时,不能被任何氧化剂氧化;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒。回答:
(1)写出五种微粒的符号:A 、B 、C 、D 、E 。
(2)C的同位素名称:C2 。
(3)C和D形成分子的电子式为 ,空间结构为 。
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为________________
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律:
(3)仪器B的名称为________,干燥管D的作用为____________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_________________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_______溶液的洗气瓶除去。
某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在纸片上,不对应,需整理):
| 实验方案 |
实验现象 |
| ①用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞 |
A.浮于水面,熔成小球,在水面上无定向移动随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 |
C.反应不十分剧烈,产生气体可以在空气中燃烧 |
| ④镁带与2 mol·L-1的盐酸反应 |
D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2 mol·L-1的盐酸反应 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠 |
F.生成淡黄色沉淀 |
请帮助该同学整理并完成实验报告。
(1)实验目的:______________________。
(2)实验用品:______________________。
(3)实验内容:
| 实验方案 (填序号) |
实验现象 (填序号) |
有关化学方程式 |
| |
|
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
(4)实验结论:_____________________。
(5)请用物质结构理论简单说明具有上述结论的原因___________________
短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:① R、Y原子的最外层电子数与电子层数相同;② Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③ W与R同主族。下列说法正确的是
| A.元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子 |
| B.元素T、Q、W、Y的原子半径大小为:T<Q<Y<W |
| C.Q与Y组成的常见物质是一种两性物质,结构中含有共价键 |
| D.由Y和T组成的物质YT,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |
有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1)B在周期表中的位置______________。
(2)CB2通入A2B2溶液中可被氧化为W,方程式为____________。用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)
电池总反应可表示为:PbO2 +Pb+ 2W= 2PbSO4 + 2H2O 。若电池中转移0.1 mol电子时,则W的浓度由质量分数39 % (密度1.3 g·cm-3)变为____________mol·L-1。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为_________________________。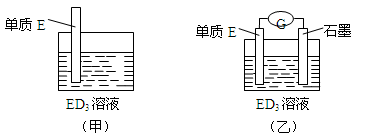
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为________________。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是 。
卤族元素包括F、Cl、Br等元素。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 。
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 ,该功能陶瓷的化学式为 。
(3)BCl3和NCl3中心原子的杂化方式分别为 和 。第一电离能介于B、N之间的第二周期元素有___ 种。
下表是元素周期表一部分,列出了九种元素在周期表中的位置:
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
|
|
|
⑤ |
⑥ |
⑦ |
⑧ |
|
| 3 |
① |
③ |
④ |
|
|
|
⑨ |
|
| 4 |
② |
|
|
|
|
|
|
|
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是 ,在③~⑦元素中,原子半径最大的是 ;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式)。写出①和④的最高价氧化物对应的水化物反应的离子方程式 。
(3)用电子式表示③和⑨形成的化合物的形成过程 。
(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式: ,该物质所含化学键类型 ,0.1mol X与水反应转移电子数为: 。
(5)表中元素⑥和⑧可形成一种相对分子量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式 。
下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 氢化物的沸点(℃) |
-60.7 |
-33.4 |
-111.5 |
100 |
-87.7 |
19.54 |
-84.9 |
-161.5 |
| 最高化合价 |
+6 |
+5 |
+4 |
|
+5 |
|
+7 |
+4 |
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是 (用表中元素编号填写)。
写出H的最高价氧化物的结构式: 。
(2)比较A、D、G三种简单阴离子的半径大小:r( )>r( )>r( )。比较元素F、G的氢化物的沸点高低,并说明理由 (均用实际的元素符号表示)。
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是: 。
(5)以下说法正确的是 (填编号)。
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
|
③ |
|
|
| 3 |
④ |
|
⑤ |
⑥ |
|
|
⑦ |
|
(1)①和②形成的最简单有机化合物分子的结构式为_____________。
(2)下列事实能证明②的非金属性比⑥强的是
A.Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+2H2O=H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(3)写出①、③、④三种元素组成化合物的电子式___________。
(4)③、④、⑤所形成的简单离子半径由大到小的顺序:___ ____。
(5)①、②、⑦三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有 种。
(6)最近科学家制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示).电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.已知该电池的负极反应为:
C4H10+13O2--26e-===4CO2+5H2O
则该电池的正极反应为__________________,电池工作时,电池中O2-向________极移动.
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;B的阴离子与D的阳离子具有相同的电子排布,可与C形成化合物D2C.
(1)B元素的名称 ;B在周期表中的位置 ;
(2)A、B形成的化合物的化学式 ;
(3)C的元素符号________,C的最高价氧化物的化学式
(4)D的最高价氧化物对应的水化物的化学式 .
(5)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是____________。
下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是____________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______(填元素符号),判断的实验依据是_______(写出一种)。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_______,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)。
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)。
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。