安徽省亳州市高一下学期期末模拟化学试卷
下列说法不正确的是
| A.通过煤的干馏可以获得焦炭 |
| B.煤液化后可以得到甲醇 |
| C.从萃取分液后溴的四氯化碳溶液中提取溴可以用分馏的方法 |
| D.煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来 |
下列说法正确的是
| A.H2O和H2O2中的化学键类型完全相同 |
| B.N2的结构式为N—N |
| C.一个D216O分子所含的中子数为10 |
D.NaCl的电子式为 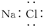 |
下列说法正确的是
| A.物质发生化学反应都伴随着能量变化 | B.吸热反应一定需要加热才能发生 |
| C.凡是放热反应的发生均无需加热 | D.伴有能量变化的物质变化都是化学变化 |
下列关于煤、石油、天然气等资源的说法正确的是
| A.石油裂解得到的汽油是纯净物 | B.煤的气化是物理变化 |
| C.天然气是一种清洁的化石燃料 | D.水煤气是通过煤的液化得到的气体燃料 |
下列属于加成反应的是
| A.己烯使酸性高锰酸钾溶液褪色 | B.将苯滴入溴水中,振荡后水层接近五色 |
| C.乙烯使溴水褪色 | D.甲烷与氯气混合光照一段时间后黄绿色消失 |
已知aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A.原子半径:A>B>C>D B.原子序数:b>a>c>d
C.离子半径:D>C>B>A D.失电子能力:B>A,得电子能力:D>C
下列说法正确的是
| A.聚乙烯可发生加成反应 | B.乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
| C.乙烯和苯都能与溴水反应 | D.乙烯和乙烷都能发生加成反应 |
已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是
| A.若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B.若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C.若该反应为放热反应,则Q1+Q2 < Q3 |
| D.若该反应为吸热反应,则Q1+Q2 < Q3 |
下列各组混合物中,可以用分液漏斗分离的是
| A.溴苯和水 | B.乙酸和乙醇 | C.酒精和水 | D.溴苯和苯 |
下列有机物的结构表示不正确的是
A.CH4的球棍模型示意图为 |
B.丁烯的键线式为 |
C.乙醇的结构式为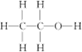 |
| D.乙酸的最简式为CH2O |
下列各组物质中,不管它们以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量不变的是
| A.乙烷和苯 | B.乙醇和丙醇 | C.乙醇和乙醚 | D.甲醛和乙酸 |
下图是产生和收集气体的实验装置,该装置最适合于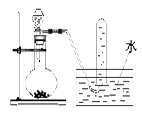
| A.用浓硝酸与Cu反应制取NO2 | B.用浓盐酸和MnO2反应制取C12 |
| C.用NH4Cl和Ca(OH)2反应制取NH3 | D.用H2O2溶液和MnO2反应制取O2 |
Cu粉放入稀H2SO4中,无现象,当再加入一种盐后,Cu粉逐渐溶解,此盐是
| A.NaCl | B.CuSO4 | C.KNO3 | D.Na3PO4 |
交警对驾驶员是否饮酒进行检测的原理是橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低
②乙醇密度比水小
③乙醇具有还原性
④乙醇是烃的含氧衍物
⑤乙醇可与羧酸在浓硫酸的作用下发生取代反应
| A.②⑤ | B.②③ | C.①③ | D.①④ |
下列说法正确的是
| A.碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 |
| B.分子组成符合CnH2n+2的烃一定是烷烃 |
| C.正戊烷分子中所有原子均在一条直线上 |
| D.碳氢原子个数比为1:3的烃有2种 |
能一次区分CH3CH2OH、CH3COOH、 和CCl4四种物质的试剂是
和CCl4四种物质的试剂是
| A.H2O | B.NaOH溶液 | C.盐酸 | D.石蕊试液 |
等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量不变的是
| A.硝酸 | B.无水乙醇 | C.石灰水 | D.盐酸 |
下列说法中正确的是
| A.决定化学反应速率的主要因素是参加反应的物质的性质 |
| B.催化剂可以使不起反应的物质发生反应 |
| C.可以找到一种催化剂使水变成汽油 |
| D.催化剂是决定化学反应速率的主要因素 |
下列反应的离子方程式正确的是
| A.硫酸与氢氧化钡在溶液中反应:Ba2++SO42- = BaSO4↓ |
| B.在NaOH溶液中加入醋酸溶液:H+ + OH- = H2O |
C.用小苏打治疗胃酸过多: + H+ = CO2↑+H2O + H+ = CO2↑+H2O |
| D.向FeI2溶液中通入过量Cl2:2Fe2++Cl2 = 2Fe3++2Cl- |
短周期元素W、X、Y和Z的原子序数依次增大。W原子是半径最小的原子,非金属元素X形成的一种单质能导电,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
| A.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| B.元素X与W形成的共价化合物有很多种 |
| C.元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
| D.元素Z可与元素X形成共价化合物XZ2 |
甲醛(CH2O)、乙酸(C2H4O2)和丙醛(C3H6O)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为
| A.27% | B.28% | C.54% | D.无法计算 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是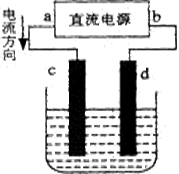
| A.d为负极、c为正极 |
| B.c电极上有气体产生 |
| C.电解过程中,Cu2+在溶液中向c棒迁移 |
| D.电解过程中,d电极质量不变,氯离子浓度不变 |
已知一定温度时:N2(g)+3 H2(g) 2NH3(g)。当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入1mol N2和3mol H2,达到平衡时放出热量为Q。则下列关系式中正确的是
2NH3(g)。当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入1mol N2和3mol H2,达到平衡时放出热量为Q。则下列关系式中正确的是
| A.Q=92 kJ | B.Q< 92 kJ | C.Q> 92 kJ | D.Q=194kJ |
下列关于电化学的说法中错误的是
| A.原电池的负极、电解池的阳极均发生氧化反应 |
| B.原电池将化学能转化为电能,电解池将电能转化为化学能 |
| C.电解水制取H2和O2时,为了增强导电性,可加入NaOH、NaCl、H2SO4 |
| D.利用原电池原理可制备化学电源,利用电解池原理可制备化学物质 |
下列说法正确的是
| A.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
| B.用溴水鉴别苯和正己烷 |
| C.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| D.乙烯和苯都能使溴水褪色,褪色的原因不相同 |
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_______,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)。
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)。
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。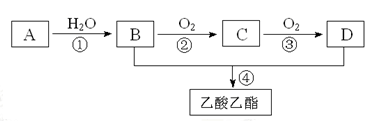
回答下列问题:
(1)写出A的电子式___________。
(2)B、D分子中的官能团名称分别___________、___________。
(3)写出下列反应的反应类型:①___________,②___________,④___________。
(4)写出下列反应的化学方程式:
① 。
② 。
④ 。
已知下表所示数据:
| 物质 |
熔点(℃) |
沸点(℃) |
密度(g·cm-3) |
| 乙醇 |
-117.3 |
78.5 |
0.79 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸 |
|
338.0 |
1.84 |
某学生实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比2∶3∶3配制浓硫酸、乙醇和乙酸的混合溶液。
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管 5~ 10 min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。
④分离出乙酸乙酯层,洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为_______________________________________。
(2)导管不能插入到Na2CO3溶液中的原因是_________________________。
(3)步骤②中需要小火均匀加热,其主要原因是__________________________________。
(4)指出步骤③所观察到的现象:____________________________________________。
(5)充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯。分离出乙酸乙酯层后,可以用用________________________洗涤。
A.乙醇 B.饱和食盐水 C.碳酸钠溶液 D.NaOH溶液
(12分)一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示: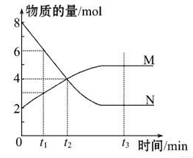
(1)该反应的化学方程式是 。
(2)在图上所示的三个时刻中, (填“t1”“t2”或“t3”)时刻处于平衡状态,此时v正 v逆(填“>”“<”或“=”);0- t2时间段内v(N)= 。
(3)已知M、N均为气体,若反应容器的容积不变,则“压强不再改变” (填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是 (选填字母)。
| A.升高温度 | B.降低压强 |
| C.减小M的浓度 | D.将反应容器体积缩小 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号