(7分) 喷泉是一种常见的自然现象,产生原因是存在压强差。
试根据下图,回答下列问题: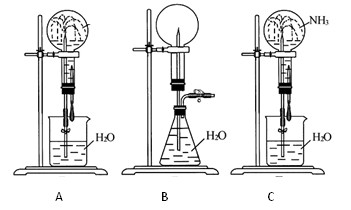
(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是( )。
A.HCl和H2O B.SO2和饱和NaHSO3溶液
C.Cl2和饱和NaCl溶液 D.CO2和NaOH溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,可能产生喷泉的是( )
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NaHCO3与浓盐酸
(3)如果提供如图C的装置,引发喷泉的方法和原理是
。
某化学学习小组对铝与酸和碱的反应进行探究,过程如下。
实验I:
(1)取形状、大小均相同的铝丝分别与等体积的、PH相同的盐酸、稀硫酸反应,随反应进行,盐酸中生成气体的速率明显比硫酸中生成气体的速率快,对此原因,你认为合理的猜测是下列的 (填写相应的字母);
a. 盐酸的物质的量浓度大于硫酸的物质的量浓度
b. Cl-能促进此反应的进行
c. SO42-能抑制此反应的进行
d. 硫酸使铝发生钝化
(2)为了探究反应速率不同的原因,请你根据所提供的药品,填写实验方案中的空白部分。
药品:氯化钠固体、硫酸钠固体、硫酸铜固体、氯化铜固体、6mol/L盐酸、3mol/L硫酸、18.4mol/L硫酸、5mol/L硝酸。
方案:取两支试管,分别加入形状、大小均相同的铝丝和等体积的 (填写相应的试剂,下同),再向其中的一支试管中加入适量的 固体并振荡使固体溶解,观察实验现象。
实验探究:略。
实验II:
取足量的形状、质量均相同的铝丝分别与等体积的6mol/L的盐酸、6mol/L氢氧化钠溶液反应,待反应停止后取出剩余的铝丝洗净、干燥、称量,剩余铝丝的质量关系是前者 后者(填“大于”或“小于”或“等于”);观察反应后的液体,发现铝与盐酸反应后所得的液体是黑色浑浊的,试管底部有少量黑色沉淀,对此现象,同学们进行了如下探究:
(1)提出猜想
同学们查找资料后获得如下信息:工业上用电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,所以得到的氧化铝中可能还含有微量的氧化铁和二氧化硅两种杂质,据此,同学们提出如下猜想:
猜想1:此黑色固体是铁单质,可能是电解得到的铝与杂质反应生成的,相应的化学反应方程式为 ;
猜想2:此黑色固体是硅单质,是电解得到的铝与二氧化硅反应生成的。
猜想3:此黑色固体是铝单质,是铝与盐酸反应时因反应过快而变成粉末分散到溶液中;
猜想4:此黑色固体可能是上述若干种单质组成的混合物。
(2)设计实验方案并完成相关实验:
将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中,完成下列实验:
① 向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解。实验时发现固体完全溶解,证明猜想 一定不正确(填“1”、“2”、“3”、“4”)。
② 向另一试管中加入足量的氢氧化钠溶液,观察固体是否溶解。实验时发现固体完全溶解,证明猜想 一定不正确(填“1”、“2”、“3”、“4”);
(3)得出结论
综合实验①②的现象,可推知猜想 (填“1”、“2”、“3”、“4”)是正确的,固体溶解在氢氧化钠溶液中的离子方程式为: 。
有学生在实验室中向盛有10mL饱和氯化铁溶液的试管里投入足量铝片,观察到如下现象:
①黄色溶液很快变成红褐色,过一会儿溶液中有红褐色沉淀生成。
②铝片表面立刻有少量黑色物质析出,黑色物质能被磁铁吸起。
③混合液温度升高甚至发烫,产生无色气泡,且产生气泡速率明显加快,铝片上下翻滚。
(1)产生的红褐色沉淀是_____________,无色气泡的成分是___________。
(2)生成红褐色沉淀的原因是____________________________。
(3)写出生成气泡速率明显加快的两个原因________ ____、_________ ____。
某校研究性学习小组选择使用下列仪器和药品,验证由铜和适量浓硝酸反应产生的气体中含有NO(实验中使用的N2和O2的用量可自由控制)。已知:①NO+NO2+2OH-====2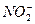 +H2O;②气体液化温度:NO2:21 ℃、NO:-152 ℃
+H2O;②气体液化温度:NO2:21 ℃、NO:-152 ℃
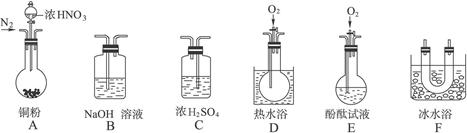
(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”):
甲:_______________;乙:_______________;丙:_______________。
具体说明不能验证的主要原因(能验证的方案,不必回答原因):
甲方案:______________________________________________________________________。
乙方案:______________________________________________________________________。
丙方案:______________________________________________________________________。
(2)实验开始时首先通入足量的N2,其目的是____________________________________。
(3)确认气体中含NO的现象是_________________________________________________。
(4)如果O2过量,则装置B中发生反应的离子方程式是______________________________。
用如图所示装置进行下列实验。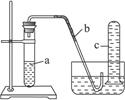
(1)在检查装置气密性后,向试管a中加入10 mL 6 mol·L-1稀硝酸和1 g铜片,立即将带有导管的橡皮塞塞紧管口。请写出试管a中有可能发生的所有反应的化学方程式________________________________________。
(2)该实验刚开始速率缓慢,随后逐渐加快,这是由于_______________________________。
(3)为了使产生的气体不至于逸散到空气中,请写出向试管a中加入试剂的操作方法______________________________________________________________________________。
(4)欲较快地制取NO,可采取的措施有(列举两种)_________________________________、________________________________________。
电子工业使用的印刷线路板,是在敷有铜膜的塑料板上以涂料保护所需的线路,然后用FeCl3的溶液与未受保护的铜膜反应以去掉铜,腐蚀后的废液中含有大量的Cu2+。为了回收这一部分Cu2+并制成硫酸铜晶体(CuSO4·5H2O),常用如下步骤:
①向废液中加过量的铁屑,搅拌,静置;②滤出固体物质;③将滤出的固体物质加热煅烧;④把煅烧后的物质放在硫酸中溶解;⑤调节溶液的pH在3.4—4之间,使Fe(OH)3沉淀完全,过滤;⑥浓缩滤液,析出晶体;⑦将过滤得到的晶体溶解,再结晶。
(1)上述③步操作所得煅烧产物成分是_______________。
A.CuO B.CuO和FeO C.CuO和Fe2O3 D.CuO和Fe3O4
(2)上述第⑤步操作中,调节溶液的pH宜加入的物质是_______________。
A.氧化铜粉末 B.NaOH溶液 C.稀氨水 D.Na2CO3
(3)上述第⑥步操作中,用浓缩滤液而不用蒸干溶液的主要原因是_______________。
A.蒸干所得到的物质可能含有无水硫酸铜
B.温度升高CuSO4溶解度增大
C.温度升高Cu2+被还原为Cu
D.温度升高CuSO4分解
下图各容器中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序是
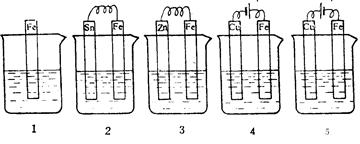 |
| A.4>2>1>3>5 | B.2>1>5>3>4 |
| C.5>2>1>3>4 | D.4>3>1>2>5 |
A~H等8种物质存在如下转化关系(反应条件、部分产物未标出)。已知A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题: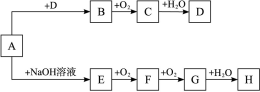
(1)写出下列物质的化学式:A______,B______,C______。
(2)写出下列反应的化学方程式:
E―→F________________________________________________________________________;
G―→H________________________________________________________________________;
D的浓溶液与木炭反应的方程式:________________________。
(3)检验某溶液中是否含D中阴离子的方法是______________________。
实验室里化学试剂的保存方法是不相同的,下图中A、B、C、D是常见的一些保存药品的试剂瓶。请把下列常见试剂的序号填写在各试剂瓶下面的括号内:①浓硫酸②碳酸钠溶液③大理石④酒精⑤氯水⑥浓硝酸
| A |
B |
C |
D |
 |
 |
 |
 |
| ( ) |
( ) |
( ) |
( ) |
大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验。
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 作干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 ,该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2,还含有CO2和水蒸气,请用下图所示装置设计一个实验,以确认上述混合气中含有CO和H2。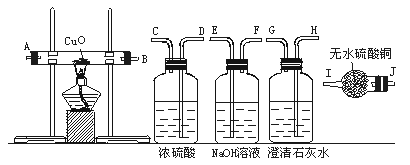
(1)连接上述装置的正确顺序是:(填接口字母)混合气→( ),( )接( ),( )接( ),( )接( ),( )接( ),( ).
(2)确认混合气中含有H2的实验现象是__________,其理由是_________________。
(12分)在右图所示的实验装置中,A中盛有品红溶液,B中盛有NaOH溶液。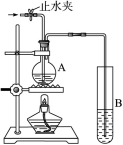 请回答下列问题:
请回答下列问题:
(1)若向A中通入足量的二氧化硫气体,A中的现象是______________________。
(2)若向A中通入足量的氯气后,再加热A,A中的溶液______(填“能”或“不能”)恢复到原来的颜色。
(3)如果A中盛的是氨水,B中盛的是无色酚酞溶液,微热A,B中溶液会变为红色,则此时表现氨水具有______性和______性。
(4)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和______性。
(5)如果A中盛的是盐酸,加入铜粉,为了让铜粉溶解,可以加入NaNO3,反应的离子方程式为:3Cu+2NO+8H+===3Cu2++2NO↑+4H2O,请用单线桥标出其电子转移的方向和数目。