北京市石景山区第一学期期末考试试卷
下列说法不正确的是
| A.08年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的知识 |
| B.我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| C.中国第1艘LNG船“大鹏昊”已于09年5月2日满载65000吨LNG,抵达广东。船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| D.2008年诺贝尔化学奖被授予研究“绿色荧光蛋白质”的美籍华裔科学家钱永健等人。蛋白质都是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔效应 |
下列叙述正确的是
①硫酸钡难溶于水和酸,可做X光透视肠胃的药剂
②蛋白质遇酒精会变性,医疗中用75%的乙醇溶液进行消毒
③棉花、蚕丝、人造羊毛的主要成分都是纤维素
④加酶洗衣粉是在洗衣粉中加入能使蛋白质水解的碱性蛋白酶,为了提高它的活性,洗衣服时温度越高效果越好
⑤碳酸钠、氢氧化钠、碳酸钙、碳酸氢钠等都可以中和酸,故都可以作为治疗胃酸过多的药物
⑥明矾净水利用了胶体的性质
⑦氢氟酸储存在玻璃瓶中
⑧可以用二氧化硅和水反应制备硅酸胶体
| A.①②③⑦ | B.①②⑥ | C.①③④⑧ | D.全都正确 |
室温时,柠檬水溶液的pH是3,其中的c(OH-)是
| A.0.1 mol/L | B.1×10-3 mol/L |
| C.1×10-7 mol/L | D.1×10-11 mol/L |
非金属氧化物采用不同的分类方法可分为不同的类别,从某种意义将N2O5、SO3、CO2、Cl2O7等归为一类。则下列氧化物与它们属于同一类的是
| A.CO | B.NO2 | C.SO2 | D.NO |
下列离子方程式正确的是
| A.用氯气作为水的消毒剂: Cl2+H2O = 2H++Cl-+ClO- |
| B.用食醋清除热水瓶胆里的水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
| C.胃药里含氢氧化铝能降低胃酸:Al(OH)3+3H+=Al3++3H2O |
| D.工业制烧碱: 2Cl-+ 2H2O = Cl2↑+H2↑+ 2OH- |
20世纪80年代人们发现和证实了碳的另一类单质,它们是一系列由偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个
C60连接而成的物质X,下列有关说法不正确的是 
| A.X难溶于水 |
| B.X是高分子化合物 |
| C.一定条件下X可与H2发生加成反应 |
| D.X的摩尔质量为720n克/摩尔 |
下列方程式中,属于水解反应的是( )
A.H2O + H2O  H3O+ + OH— H3O+ + OH— |
| B.HCO3— + OH— ="" H2O + CO32— |
C.CO2 + H2O  H2CO3 H2CO3 |
D.CO32— + H2O  HCO3— + OH— HCO3— + OH— |
在指定的溶液中一定可以大量共存的离子组是
| A.使石蕊变红的溶液中: Na+、I-、Cl-、NO3-、C6H5O- |
| B.在强碱性溶液中:Na+、K+、AlO2-、CO32-、SiO32- |
| C.在无色透明溶液中:NH4+、Fe3+、SO32-、NO3- |
| D.由水电离出来的c(H+) = 1×10-13 mol/L的溶液中:K+、CO32-、Cl-、NO3- |
氯气是一种重要的化工原料。工业上利用反应:3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
| A.若管道漏气遇氨就会产生白烟 |
| B.该反应利用了Cl2的强氧化性 |
| C.生成1 mol N2有6 mol电子转移 |
| D.该反应属于复分解反应 |
下列说法正确的是
| A.7.1 g C12与足量NaOH溶液反应转移0.2×6.02×1023个电子 |
| B.28 g乙烯和丙烯的混合气体中含有2×6.02×1023个碳原子 |
C.标准状况下,2.24 L H2O含有的分子数等于0.1 NA |
| D.2.9 g乙基(一C2H5)含有的电子数为1.8 NA个 |
有关下图所示化合物的说法不正确的是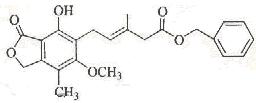
| A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 |
| B.1 mol该化合物最多可以与3 mol NaOH反应 |
| C.既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内是离子“流过”水和氧化锌组成的电解液。电池总反应为:Zn + 2 MnO2十H2O =" ZnO" + 2MnO (OH)。下列说法正确的是
| A.该电池的正极为锌 |
| B.电池正极反应式为: 2MnO2 + 2e-+ 2H2O =" 2MnO" (OH)十2OH- |
| C.当 0.l mol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 |
| D.该电池反应中二氧化锰起催化作用 |
为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
| A.KI(淀粉溶液) | B.FeCl2溶液(KSCN) |
| C.Na2SO3溶液(BaCl2) | D.HCHO溶液(石蕊试液) |
X、Y、Z、W为四种短周期主族元素。其中X、Z同主族,Y、Z同周期,W与X、
Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正
价与最低负价的代数和为6。下列说法正确的是
| A.X与W可以形成W2X、W2X2两种化合物 |
| B.Y元素最高价氧化物对应水化物的化学式为H2YO4 |
| C.Z的氢化物的沸点比X的氢化物的沸点高 |
| D.Y、Z两元素的简单离子的半径Y>Z |
MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
| A.c(M+)>c(OH-)>c(A-)>c(H+) |
| B.c(M+)> c(A-) > c(H+)> c(OH-) |
| C.c(M+)> c(A-) > c(OH-) >c(H+) |
| D.c(M+)> c(H+) >c(A-)> c(OH-) |
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加
过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在
内的沉淀,再经蒸发、结晶,可得纯净的MnCl2 ,根据上述实验事实可推知MnS具
有的相关性质是
| A.具有吸附性 |
| B.溶解度与CuS、PbS、CdS等相同 |
| C.溶解度大于CuS、PbS、CdS |
| D.溶解度小于CuS、PbS、CdS |
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) ="==" 2CO2(g)+2H2O(l) △H1= -870.3 kJ·mol-1
(2)C(s)+O2(g) ="==" CO2(g) △H2= -393.5 kJ·mol-1
(3)H2(g)+O2(g) ="== " H2O(l) △H3= -285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l) 的焓变△H为( )kJ·mol-1
| A.488.3 | B.-244.15 | C.244.15 | D.-488.3 |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与2.24 L O2(标准状况)混合后通入水中,气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入100 mL NaOH溶液,此时Cu2+恰好沉淀完全,所用NaOH溶液的浓度是( )mol·L-1
| A.1 | B.2 | C.3 | D.4 |
在一定温度下,反应

 的平衡常数为9。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于
的平衡常数为9。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于
| A.10% | B.18% | C.20% | D.40% |







 粤公网安备 44130202000953号
粤公网安备 44130202000953号