NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)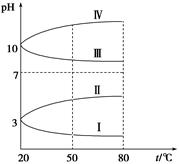
如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= 。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
某温度下,饱和石灰水的溶解度为Sg,密度为ρg/mL,向足量该饱和溶液中加入mgCaO,充分作用后,恢复到原来温度,下列有关说法不正确的是( )
| A.最终得到沉淀的质量大于 37m/28g |
| B.该饱和溶液质量百分比浓度为 s/(100+s)% |
| C.最终所得溶液PH不变 |
D.该饱和溶液中溶质物质的量浓度为 |
实验是化学学习的基础。下列实验叙述正确的是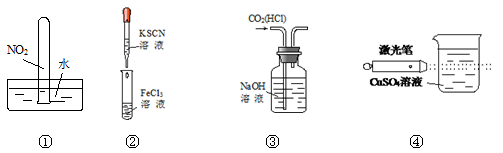
| A.实验①试管最终会充满水 |
| B.实验②试管中溶液变为血红色 |
| C.可用实验③装置除去CO2气体中含有的少量HCl杂质 |
| D.实验④检验硫酸铜溶液 |
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为 m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是 。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
| A.CuO | B.Al(OH)3 | C.NaOH | D.NaHCO3 |
若调节后溶液的pH偏离3.5,可能带来的后果是 。
下列推断合理的是
| A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B.向50mL 18mol/L 硫酸中加入足量铜片并加热,被还原硫酸的物质的量是0.45mol |
| C.浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗 |
| D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水色后加热也能恢复原色 |
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇KSCN溶液呈红色。
请回答下列问题:
(1)Y的最高价氧化物对应水化物的化学式是____________________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式____________。
此液体具有的性质是____________(填字母)。
| A.光束通过该液体时形成光亮的“通路” |
| B.插入电极通直流电后,有一极附近液体颜色加深 |
| C.向该液体中加入硝酸银溶液,无沉淀产生 |
| D.将该液体加热、蒸干、灼烧后,有氧化物生成 |
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率__________。
②原无色有刺激性气味的气体与含1.5 mol Y的含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应。可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是(用单线桥表示电子转移方向和数目):_____________________________________________。
(4)室温时,pH=5的HY溶液和pH=5的ZY3溶液中,水电离出的氢离子分别是 mol·L-1和
mol·L-1
央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。CrO2-是一种酸根离子,则Fe(CrO2)2属于____(填“酸”、“碱”、“盐”或“氧化物”)。明胶的水溶液和K2SO4溶液共同具备的性质是 。
a.都不稳定,密封放置沉淀
b.两者均有丁达尔现象
c.分散质粒子可通过滤纸
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方式: 。
②(CN)2和NaOH溶液反应的离子方程式: 。
(3)已知H2O2是二元弱酸、请写出H2O2与Ca(OH)2溶液反应生成酸式盐的化学式 。
下列有关化学用语的书写或表述正确的是
A.用铜做电极电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↓ 2NaOH+H2↑+Cl2↓ |
| B.稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol |
| C.切开的金属Na暴露在空气中,光亮表面逐渐变暗4Na+O2=2Na2O |
D.向沸腾的蒸馏水中逐滴加入1.0 mol/LFeCl3溶液,至液体呈透明的红褐色Fe3++3H2O Fe(OH)3↓+ 3 H+ Fe(OH)3↓+ 3 H+ |
硫酸钠是一种重要的化工原料,其溶解度曲线如图所示.下列说法正确的是
| A.硫酸钠的溶解度随温度升高而增大 |
| B.30℃时硫酸钠饱和溶液的质量分数为40% |
| C.40℃时硫酸钠的溶解度约为50g |
| D.60℃时硫酸钠饱和溶液降温后一定饱和 |
用下列方法来制备胶体,能够得到胶体的是
| A.将等体积、等物质的量浓度的BaCl2溶液和硫酸相混合并振荡 |
| B.把1 mL饱和三氯化铁溶液逐滴加入到20 mL温水中,边加边振荡,并加热到沸腾 |
| C.把1 mL饱和三氯化铁溶液一次性加入到20 mL沸水中,并加以搅拌 |
| D.把1 mL饱和三氯化铁溶液逐滴加入到20 mL沸水中,边加边振荡 |
某学校开展文化周活动,活动内容有征文比赛、歌咏比赛等等,其中有一项活动是分学科的创新思维大赛。其中化学科的比赛题目之一是“假如光照条件下没有丁达尔效应……”。假如你是参加该校创新思维大赛的一名学生,请你完成你的作品。
储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应中的反应物和生成物有C、CO2、H2SO4、KCr2O7、Cr2(SO4)2、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,所具的性质有
①丁达尔效应;②加入饱和(NH4)2SO4溶液产生聚沉;③可通过半透膜。
(2)请用上述物质填空,配平化学方程式,并标出电子转移的方向和数目(
C+ + H2SO4→ K2SO4+ + Cr2(SO4)3+ H2O
(3)将标准状况下4.48 L产生的气体通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0g。
(I)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入该气体 g。
(Ⅱ)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是 或 。
②若只能加入0.10 mol某物质,则加入的物质可以是 或 。