辽宁省大连24中上学期高三年级期中考试化学试卷
光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法正确的是 ( )
| A.二氧化硅是H2SiO3的酸酐,因此能与水反应 |
| B.用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅 |
| C.光导纤维遇强碱和强酸会发生“断路” |
| D.二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温时发生反应 |
现有一种简单可行的测定阿伏加德罗常数的方法,具体步骤为:(1)将固体NaCl细粒干燥后,准确称出m克NaCl固体并转移到定容仪器a中。(2)用滴定管b向a仪器中滴加某液体c,不断振荡,加至a仪器的刻度线,计算出NaCl固体的体积为Vcm3,再通过NaCl的体积和质量,即可算出阿伏加德罗常数.上述操作中的a、b、c分别指 ( )
| A.量筒、酸式滴定管、水 | B.容量瓶、碱式滴定管、苯 |
| C.量筒、碱式滴定管、水 | D.容量瓶、酸式滴定管、四氯化碳 |
一定温度下,向质量分数为a的乙腈(CH3CN)溶液中加入等体积的水,所得溶液中乙腈的质量分数为0.4a,若乙腈的密度为 ,水的密度为
,水的密度为 ,则下列说法正确的是 ( )
,则下列说法正确的是 ( )
A. |
B. |
C. |
D.无法确定 |
将氯气溶于草木灰的浸出液所得溶液比氯水的漂白能力更强,而且无逸出氯气的有害作用。请你根据所学知识判断下列说法错误的是 ( )
| A.碳酸的酸性弱于盐酸,但强于次氯酸 |
| B.氯气通入草木灰的溶液中发生反应2K2CO3+Cl2+H2O=2KHCO3+KCl+KClO |
| C.氯气通入草木灰的溶液中发生反应K2CO3+Cl2+H2O=KHCO3+KCl+HClO |
| D.草木灰溶液本身不具有漂白作用,但具有去污作用 |
下列实验过程能引起结果偏高的是 ( )
①配制100gl0%CuSO4溶液,称取l0g硫酸铜晶体溶于90g水中
②测定硫酸铜晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的硫酸溶液时,定容时俯视容量瓶的刻度线
④质量分数为10%和90%的两种硫酸等质量混合配制50%的硫酸溶液
| A.①④ | B.②④ | C.②③ | D.②③④ |
用NA示阿伏加德罗常数,下列说法正确的是 (
| A.1molOH一含有电子数为9NA |
| B.6.25 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.1NA |
| C.由CH4和C2H6组成的混合物中共有NA个分子,其中的氢原子数为5NA |
| D.0.1 mol Na2O2中,阴离子的个数为0.1NA |
下列离子方程式正确的是 ( )
| A.制取Fe(OH) 3胶体:Fe3++3H2O |
| B.1 mol/L的NaAlO2溶液和2.5 mol/L的盐酸等体积混合:2AlO2-+5H+= Al(OH) 3↓+Al3++H2O |
| C.向碘化钾溶液中通入臭氧:O3+2I一+3H2O |
| D.等物质的量的Ba(OH) 2与(NH4)2Fe(SO4) 2在溶液中反应:Ba2++2OH-+2NH4++SO42- |
向含有下列离子的溶液中加入足量的NaOH溶液,静置,过滤,取出沉淀洗涤后,向沉淀中加入足量的盐酸,得到的溶液所含金属离子的种类与原溶液相同的是 ( )
| A.Na+、Ag+、Mg+ | B.Fe2+、Mg2+、NH4+ |
| C.Al3+、Ca2+、Cu2+ | D.Mg2+、Fe3+、Cu2+ |
CO2与H2的混合气体5 g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4 g,则原混合气体中CO2的物质的量分数为 ( )
| A.25% | B.75% | C.88% | D.32% |
下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是( )
| A.Mg2+、Na+、Cl-、SO42- | B.K+、CO32-、Cl-、NO3一 |
| C.Na+、K+、NO3-、SO32- | D.NH4+、Na+、SO42-、NO3- |
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1 Fe2(SO4) 3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是 ( )
| A.所得沉淀为0.05 mol的BaSO4 | B.混合气体中SO2的体积为0.448 L |
| C.a L混合气体的物质的量为0.04 mol | D.a的取值范围为0.672<a<0.896 |
现有X、Y、Z三种气体,相对分子质量关系为Mr(x)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )
| A.若三种气体物质的量相等,则它们的体积一定相等 |
| B.等质量的三种气体,所含分子数目关系为N(X)>N(Z)>N(Y) |
| C.标准状况下,三种气体中分子间的平均距离均相同,分子质量也相等 |
| D.20℃时,若2 mol Y与l mol Z体积相等,则Y、Z气体所产生的压强比为2:l |
某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1mol。
若向原溶液中加入足量的盐酸,有无色气体生成。经分析反应后溶液中阴离子的种类没有变化。则该溶液含有的离子组成为 ( )
| A.Cl-、NO3-、SO42-、Fe2+、Mg2+ | B.HCO3-、Cl-、CO32-、Fe2+、Mg2+ |
| C.SO42-、CO32-、NO3-、Cu2+、Fe2+ | D.Al3+、K+、Cl-、NO3-、SO42- |
将铁铝硅合金样品分等量两份分别与足量稀盐酸和烧碱充分反应放出氢气质量相同。合金中铁铝硅质量比不可能是 ( )
| A.112:8l:28 | B.336:27:84 | C.324:135:8l | D.56:8l:56 |
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是 ( )
| A.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| B.V1:V2=1:5 |
| C.a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
| D.M点时生成的CO2为0.05mol |
某活动小组利用如图装置验证N的还原性及探究工业生产硝酸的原理。
如何检查该装置气密性 。
(一)向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加入水,让水充满广口瓶①,且调节滴定管③中液面与①相平并记录滴定管③的刻度。
(2)从导管a通入一定量的NO并准确测定通入NO的体积的主要操作: ;计算出通入的NO的体积为V mL(V<50)。
(二)验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,写出通入O2的过程中发生的化学反应方程式: 。
(2)继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体。
I.当通入氧气的体积为V/2mL时,则广口瓶①的气体体积为 ;
II.当广口瓶①的气体体积为V/2 mL时,则通入氧气的体积可能为 。
下图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质,而I是红棕色的气态氧化物。固态物质A加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示:
请回答下列问题: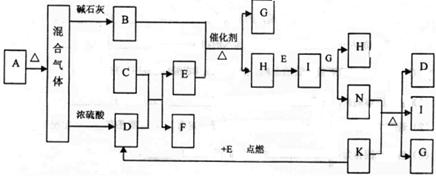
(1)写出实验室检验A物质中含有的阳离子的方法 。
(2)B与E反应得到1mol H,则此时转移电子的物质的量为 mol。
(3)写出实验室制取B的化学方程式 。
(4)写出N的稀溶液与过量的铁粉反应的离子方程式 。
(5)若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的物质的量之比是8:5,则用物质的量的关系表示此固体A的组成为 。
储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应中的反应物和生成物有C、CO2、H2SO4、KCr2O7、Cr2(SO4)2、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,所具的性质有
①丁达尔效应;②加入饱和(NH4)2SO4溶液产生聚沉;③可通过半透膜。
(2)请用上述物质填空,配平化学方程式,并标出电子转移的方向和数目(
C+ + H2SO4→ K2SO4+ + Cr2(SO4)3+ H2O
(3)将标准状况下4.48 L产生的气体通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0g。
(I)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入该气体 g。
(Ⅱ)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是 或 。
②若只能加入0.10 mol某物质,则加入的物质可以是 或 。


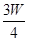 g,则溶液中的阳离子一定有 ,一定没有 .
g,则溶液中的阳离子一定有 ,一定没有 . 粤公网安备 44130202000953号
粤公网安备 44130202000953号