(8分)(1)下图是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物可能的结构简式为
______________________、______________________。
(2)已知1丙醇和2丙醇的结构简式如下:
1丙醇:CH3CH2CH2OH
2丙醇:
下图是这两种物质中其中一种的核磁共振谱,并且峰面积比分别为1∶1∶6,
请指出该核磁共振谱表示的物质是____________,
(3)某有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
①该化合物的相对分子质量是________。
②该化合物的化学式是_______________。
.药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(1,4-环己二酮单乙二醇缩酮)和Y(咖啡酸)为原料合成,如下图:
(1)化合物X的有 种化学环境不同的氢原子。
(2)下列说法正确的是 。
| A.X是芳香化合物 | B.Ni催化下Y能与5molH2加成 |
| C.Z能发生加成、取代及消去反应 | D.1mol Z最多可与5mol NaOH反应 |
(3)Y与过量的溴水反应的化学方程式为 。
(4)X可以由 (写名称)和M(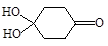 )分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如:
)分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如: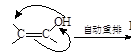
 )。
)。
(5)Y也可以与环氧丙烷(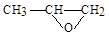 )发生类似反应①的反应,其生成物的结构简式为 (写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有 种。
)发生类似反应①的反应,其生成物的结构简式为 (写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有 种。
按要求完成下列问题:
(1)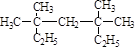 系统命名为 ;
系统命名为 ;
(2)4―甲基―1―戊烯的键线式为 。
(3)写出乙醛与新制氢氧化铜反应化学方程式 ;
(4)丙三醇与硝酸反应能生成三硝酸甘油酯,写出三硝酸甘油酯的结构简式
(5)下列有关实验的说法不正确的是_____________。
| A.制乙烯时,温度计应插入反应混合液中 |
| B.实验室用溴和苯在铁粉存在下反应,得到的溴苯显褐色,原因是溴苯在空气中被氧化 |
| C.检验C2H5Cl中氯元素时,将C2H5Cl和NaOH水溶液混合加热,然后用稀硫酸酸化,再加入AgNO3溶液 |
| D.做过银镜反应的试管用氨水洗涤,做过苯酚的试管用酒精洗涤 |
E.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热未产生砖红色沉淀,原因可能是NaOH量太少
A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量不变,完全燃烧后所产生的CO2的质量就不变。
(1)试写出两组符合上述情况的烃的结构简式:
________________和________________;
________________和________________。(与第一组的物质类别不同)
(2)A、B应满足的条件是_____________________________________________。
有机物A〜M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。

请回答:
(1)B、F的结构简式分别为 、 。
(2)反应①〜⑦中,属于消去反应的是 (填反应序号)。
(3)D发生银镜反应的化学方程式为 ;反应⑦的化学方程式为 。
(4) A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为 。
(5)符合下列条件F的同分异构体共有 种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
完成下列小题(共12分)
(1)主链含5个碳原子,有2个甲基作支链的烷烃有_______种。其中有一种同分异构体的分子,其一氯代物有4种同分异构体,写出其结构简式___________________,并对其命名____________。其中另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称______________.
(2)已知某有机物A在标况下的密度为1.34g/L,取A与氧气反应,得到等物质的量的CO2和H2O,则该有机物的分子式为______________。为测定A的结构,作核磁共振氢谱,发现只有一种吸收峰,则A可能的结构简式为____________。
【化学——选修2:化学与技术】丙酮和苯酚都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(g/cm﹣3) |
沸点/℃ |
|
| 苯酚 |
94 |
1.0722 |
182 |
|
| 丙酮 |
58 |
0.7898 |
56.5 |
|
| 异丙苯 |
120 |
0.8640 |
153 |
|
回答下列问题:
(1)反应①和②分别在装置 和 中进行(填装置符号).
(2)反应②为 (填“放热”或“吸热”)反应.反应温度控制在50﹣60℃,温度过高的安全隐患是 .
(3)在反应器A中通入的X是 .
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是 ,优点是用量少,缺点是 .
(5)中和釜D中加入的Z最适宜的是 (填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 .
(7)用该方法合成苯酚和丙酮的优点是 .
(6分)0.2 mol有机物与0.5 mol O2恰好完全燃烧后的产物为CO2和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过碱石灰剩余气体被完全吸收,碱石灰质量增加17.6 g。
(1)燃烧后产物的物质的量分别为CO2________mol、H2O(g)__________mol。
(2)推断该有机物的分子式为_____________。
(3)若0.2 mol该有机物恰好与9.2 g金属钠完全反应,其核磁共振氢谱显示只有两种不同环境的H,试确定该有机物的结构简式为____________。
2012年2月20日《南方日报》A12版报道了如下几种饮料添加剂:对羟基苯甲酸甲酯、苯甲酸钠、塑化剂等,请回答以下相关问题:
(1)对羟基苯甲酸甲酯的分子式为________。请写出对羟基苯甲酸甲酯符合下列所有条件的任意一种同分异构体________。
A.有醛基 B.有苯环 C.苯环上氢只有一种
(2)苯甲酸钠________(填“难”或“易”)溶于水,其水溶液显________(选填“酸”、“碱”或“中”)性,理由是____________________________________________________________(用离子方程式表示)。
(3)邻苯二甲酸二丁酯是塑化剂之一,它的另外两种性质基本相同的同分异构体是______________________________________________________________________
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应方程式和实验装置如下: 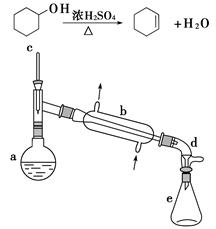
可能用到的有关数据如下:
| |
相对分 子质量 |
密度/ (g·cm-3) |
沸点/℃ |
溶解性 |
| 环己醇 |
100 |
0.961 8 |
161 |
微溶于水 |
| 环己烯 |
82 |
0.810 2 |
83 |
难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5% 碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
(1)装置b的名称是__________。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案序号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为______________。
(4)分液漏斗在使用前必须清洗干净并______。在本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口倒出”)。
(5)分离提纯过程中加入无水氯化钙的目的是__________________。
(6)在环已烯粗产物蒸馏过程中,不可能用到的仪器有______(填正确答案序号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。
实验结论:A的相对分子质量为 。
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。则A的分子式为 。
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。
实验结论:A中含有的官能团: 、________。
(4)A的核磁共振氢谱如图:
实验结论:A中含有 种氢原子。
(5)综上所述,A的结构简式_________________。
将含有C、H、O三种元素的有机物3.24g装入元素分析装置,通入足量的O2使其完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B,测得A管质量增加了2.16g,B管质量增加了9.24g。已知该有机物的相对分子质量为108,试计算:
(1)通过计算写出该化合物的分子式
(2)写出其中符合下列条件的该化合物可能的结构简式
①含有苯环
②苯环上有两个取代基
(3)其中苯环上一氯代物只有两种的结构简式
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A、D装置可以重复使用。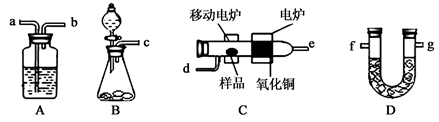
请回答下列问题:
(1)请按气体流向连接实验装置B→ →C→A→D→ (用装置编号填写)。
(2)B装置中制O2时所用的药品是 。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是 ;停止加热后,也要再通一段时间的氧气,目的是 .。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式 。
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:实验一:X在一定条件下可催化氧化最终生成有机物Y;实验二:X与Y在浓硫酸加热条件下生成有机物Z。则:①写出实验二中反应的化学方程式 。
② 除去Z中混有的Y所需的试剂和主要仪器是 、 。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式 。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水,为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍 |
(1)A的相对分子质量为:________ |
| (2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g |
(2)A的分子式为:________ |
| (3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属的反应则生成2.24 L H2(标准状况) |
(3)用结构简式表示A中含有的官能团:________、________ |
| (4)A的核磁共振氢谱如图: |
|
 |
(4)A中含有________种氢原子 |
| (5)综上所述,A的结构简式为________ |